액티와치로 측정한 객관적 짧은 수면시간, 주관적 짧은 수면시간, 정상 수면시간 불면증 아형의 임상적 특성
Clinical Differences of Insomnia Subtype According to Actigraphy Based Objective Short Sleep, Subjective Short Sleep, and Normal Sleep
Article information
Trans Abstract
Objectives
This study aims to examine the clinical differences between objective short sleep insomniacs (OSSI) and subjective short sleep insomniacs (SSSI).
Methods
We enrolled 79 patients (aged 27–74 years) with chronic insomnia disorder (CID) who underwent overnight polysomnography (PSG) and completed sleep-related questionnaires as well as habitual sleep time. All of them completed actigraphy (ACT) recording for one week prior to the PSG study. Objective sleep duration for one-week average sleep was calculated by ACT, and subjective sleep duration was counted through self-reported habitual sleep time. We divided the subjects into three groups; OSSI (<6 h/night), SSSI (objective sleep ≥6 h/night and subjective sleep <6 h/ night), and normal sleep duration insomniacs (NSDI, subjective sleep ≥6 h/night).
Results
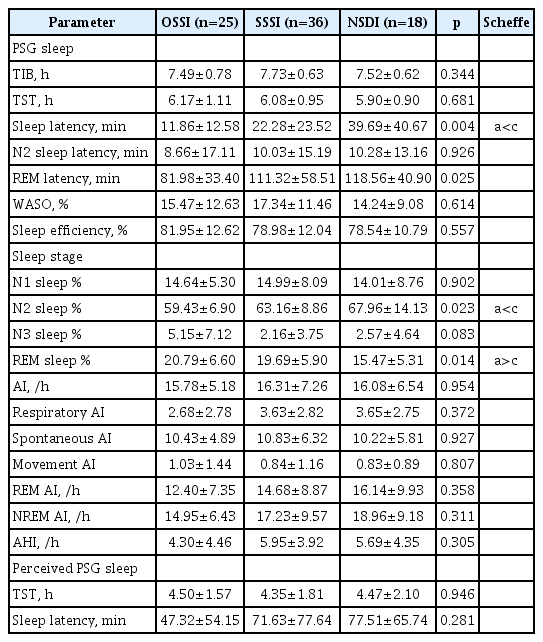
The three groups namely OSSI, SSSI, and NSDI had 25 (31.6%), 36 (45.6%), and 18 (22.8%) subjects, respectively. The SSSI were significantly older and had higher daytime sleepiness than the OSSI. According to the PSG results, the OSSI showed shorter sleep latency (11.86 min vs. 39.69 min) and N2 sleep % (59.43% vs. 67.96%), and longer rapid eye movement sleep % (20.79% vs. 15.47%) than that in the NSDI. There was no difference in treatment response between groups.
Conclusions
45.6% of CID patients underestimated their sleep relative to objective sleep. However, there were no differences in total sleep time on PSG between groups. The OSSI showed younger age and more daytime sleepiness, and the SSSI showed poorer sleep quality than the NSDI. These findings suggest that long-term ACT recording in a casual environment would be useful to monitor objective sleep in patients with CID, particularly, in subjectively short sleep insomniacs.
서 론
불면증은 적절한 수면 기회와 환경에도 불구하고 지속적으로 수면에 대한 어려움과 주관 장애를 일으키는 질환으로, 국제수면장애진단분류 3판(International Classification of Sleep Disorders, ICSD-3)에서는 이러한 증상이 주 3회 이상, 3개월 이상 지속될 때 만성 불면장애(chronic insomnia disorder, CID)로 진단하며, 유병률은 전체 인구의 약 10%에 달한다[1]. 과거 불면장애는 동반 원인이나 공존 질환을 고려해서 11가지 유형으로 상세하게 분류하였지만, 환자들이 여러가지 유형을 동시에 가지고 있어 구분이 어렵다는 비판이 계속되면서, ICSD-3에서는 불면장애 아형을 지속 기간 중심으로 단기, 만성 불면장애 및 기타 불면장애로 구분하고 있다. 그럼에도 환자에게 적절한 진단과 치료를 위해 불면장애 아형을 나누려는 시도는 지속되고 있으며, 대표적인 구분이 주관적 불면증(subjective insomnia)과 객관적 불면증(objective insomnia)의 분류이다[2].
불면증 환자들은 건강한 정상인이나 수면무호흡증 환자들에 비해 자신의 수면시간에 대해 저평가하는 경향을 보이며[3], 특히 객관적 지표는 이상이 없지만 스스로 불면증을 호소하는 경우 주관적 불면증 또는 역설적 불면증(paradoxical insomnia)이라고 한다[2]. 반면, 객관적인 수면시간이 6시간 미만으로 짧은 불면증 환자들(objective short sleep insomniacs, OSSI)은 수면시간이 6시간 이상인 불면증군이나 수면시간이 짧은 정상군보다 고혈압 발병률이 높고, 사망 위험률도 증가하며,4,5 불면증 인지행동치료(cognitive behavior therapy for insomnia, CBT-I)에 대한 반응도 낮은 것으로 보고되고 있다[6]. 이러한 OSSI는 정상 수면시간 불면증과 임상적 특성이나 병인이 다르며, 생물학적으로 가장 심각한 불면증 유형으로 구분되기도 한다[7,8] 따라서 전체 CID 중 OSSI를 확인하여 보다 적극적인 치료적 접근이 필요하다.
OSSI를 확인하기 위해서는 수면다원검사와 같은 객관적 검사가 필요하지만 아직까지 국내에서는 수면무호흡증이 의심되는 경우에만 보험적용을 받을 수 있어 불면증 환자들에게 쉽게 적용할 수 있는 검사는 아니다. 또한, 불면증의 경우 정상군에 비해 수면시간의 변동폭이 더 크며[9], 주변환경에 영향을 받는 불면증의 특성을 고려한다면 낯선 공간에서 하루 밤의 수면다원검사가 불면증 환자의 평소 수면을 정확히 반영한다고 말하기에는 제한점이 있다.
이에 반해 액티와치(actigraphy, ACT)는 비우세 손목에 시계처럼 착용하여 움직임에 기반해서 수면과 각성을 측정할 수 있어 비침습적이면서도 일상 환경 하에서 장기간 수면을 모니터링할 수 있기 때문에 불면증 환자의 진단과 평가에 유용한 검사이다[10,11]. ACT는 수면의 단계를 평가할 수 있는 뇌파를 측정하지 않기 때문에 수면다원검사만큼 정확하게 수면을 측정할 수 없다는 단점이 있지만, 불면증 환자에서 수면다원검사와 일치율이 높은 것으로 보고되고 있어[12] 주관적 불면증을 감별하기 용이할 것으로 보인다.
이에 본 연구에서는 ICSD-3 기준에 따라 불면증 유병 기간이 3개월 이상인 CID 중에서 ACT를 1주 이상 착용하여 평소 수면을 기록하고 동시에 수면다원검사도 시행했던 환자들을 대상으로 주관적 수면시간과 객관적 수면시간에 따른 환자들의 특성 및 치료 결과를 비교해보고자 한다. 이를 통해 주관적, 객관적 수면장애에 따라 치료 방법이나 치료 결과에 차이가 있는지를 확인하여 불면증 환자의 치료 개선을 위한 기초자료를 제공하고자 한다.
방 법
대 상
본 연구는 의무기록을 이용한 후향적 조사로, 2014년 8월부터 2018년 7월까지 불면증을 주소로 서울소재 일개 상급종합병원 수면클리닉에서 1주일 이상 액티와치를 착용하고, 착용 기간 중 하루 동안 야간수면다원검사를 시행한 환자들을 대상으로 하였다. 연구 대상은 ICSD-3 기준에 따라 주 3회 이상 수면장애 증상을 호소하고 지속기간이 3개월 이상인 20세 이상 CID 환자 중, 설문 작성이 가능한 내국인으로, 교대근무자, 비정상적 일주기리듬장애질환, 수면호흡장애(apnea-hypopnea index [AHI] ≥15/h), 하지불안증후군, 기면증, 렘수면장애, 주기적 사지운동증(movement arousal index≥5/h)과 같은 주요 수면장애나 정신질환이 있는 환자는 제외하였다. 총 123명의 자료 중에서 교대근무자(n=2), 일주기리듬장애(n=9), 기타 수면장애(n= 31; 수면호흡장애 20, 주기적 사지운동증 10, 하지불안증후군 1), 설문 작성 미비자(n=2)를 제외한 79명의 자료가 분석에 포함되었다. 분석 대상자 중, 주관적으로 기술한 평소 수면시간이 6시간 미만(subjective habitual sleep <6 h/night)인 대상자 중 액티와치로 확인된 평균 수면시간이 6시간 미만(1-week average sleep by actigraphy <6 h/night)인 경우는 객관적 짧은 수면시간 호소군(OSSI), 수면시간이 6시간 이상인 경우는 주관적 짧은 수면시간 호소군(subjective short sleep insomniacs, SSSI)으로 구분하였고, 평소수면시간이 6시간 이상인 경우는 정상수면시간 수면장애군(normal sleep duration insomniacs, NSDI)으로 구분하였다(Fig. 1).

We enrolled 79 patients with chronic insomnia disorder who underwent overnight polysomnography (PSG) and actigraphy (ACT) recording for one week previous before PSG study. Objective sleep were calculated by ACT for 1-week average sleep duration and subjective sleep duration was counted by self-reported habitual sleep. We divided the subjects into 3 groups; OSSI (objective and subjective sleep duration <6 h/night), SSSI (objective sleep ≥6 h/night and subjective sleep <6 h/night), and NSDI (subjective sleep ≥6 h/night).
본 연구에 사용된 연구 기준, 방법 및 평가는 삼성서울병원 기관윤리심의위원회의 심의(승인번호: 2021-04-021)와 동의면제 승인을 획득하였으며, 기관윤리심의위원회의 관리 감독하에 시행되었다.
측정도구
수면다원검사
수면다원검사는 Embla N7000 (Medcare-Embla, Reykjavik, Iceland) 장비로 시행되었다. 6채널의 뇌파와 4채널의 안전위도, 1채널의 턱 근전도를 비롯하여, 흉부와 복부의 호흡 유도 체적변동기록기(respiratory inductive plethysmography), 산소포화도, 심전도, 근전도, 소리 센서 등을 통하여 수면 단계와 호흡지수, 사지운동지수 등을 측정하였고, 검사평가는 American Academy of Sleep Medicine Manual에 따라 판독 되었다[1].
수면양상은 총 침상시간(time in bed, TIB), 총 수면시간(total sleep time, TST), 수면잠복기(sleep onset latency, SOL), 2단계 수면잠복기(N2 sleep latency), 렘수면잠복기 (rapid eye movement sleep latency), 입면 후 각성시간 (wakefulness after sleep onset, WASO), 수면 효율(sleep efficiency, SE)로 측정하였고, 무호흡-저호흡지수(AHI), 총 각성지수(total arousal index) 및 호흡각성지수(respiratory arousal index), 자발각성지수(spontaneous arousal index), 운동각성지수(movement arousal index)를 추가로 평가하였다.
액티와치
액티와치(ACT)는 움직임에 기반하여 수면-각성을 측정할 수 있는 검사로, Actiwatch 2 (Phillips Respironics, Murrysville, PA, USA)를 이용하여 비우세 손목에 주말을 포함하여 1주 이상 착용하여 측정하였다. 측정된 움직임의 강도는 30초에폭(epoch)의 평균값으로 기록되었으며, Actiware version 5.70 sleep software (Philips Respironics)를 이용해서 프로그램 알고리즘의 역치 계산에 의해 각성 또는 수면이라는 이진수로 변환되어 측정된다. Activity threshold와 sleep onset과 end를 결정하는 immobile minutes setting에 따라서 수면-각성 분석 값이 변할 수 있는데[13], 본 연구에서는 default setting으로 medium activity threshold (40 counts/epoch)와 10분을 사용하였다[14]. 액티와치를 통해 착용 기간 동안 일별 TIB, TST, SOL, WASO, SE 등을 측정할 수 있으며, 본 연구에서는 착용 기간 동안의 평균값으로 평가하였다. 수면시간 불일치(discrepancy of TST)는 ACT TST (objective TST, oTST)에서 주관적으로 기술한 평소 수면 시간(subjective TST, sTST)을 뺀 값(oTST-sTST)이며, 오지각 지수(Misperception Index)는 [oTST-sTST]/oTST로 계산한 값으로 양의 값은 수면시간을 저평가(underestimation)하는 것이며, 음의 값은 수면시간을 과대평가(overestimation)하는 것을 의미 한다[15].
치료 방법 및 치료 효과
불면증 치료 방법은 담당의가 처방한 기록을 통해 확인하였고, 치료 효과는 진료 시 환자가 기술한 증상을 바탕으로 담당의가 치료 효과 여부를 판단한 기록으로 평가하였다. 연구대상 병원에서 CBT-I 수행은, CBT-I 치료자 교육과정을 이수하고 미국 Penn Medicine 수면센터에서 실무교육을 받은 박사급 전문간호사 1인이 1-2주 간격으로 총 4회기 개별 교육으로 진행하였으며, 세부적인 교육 내용은 선행 논문에 기술되어 있다[24].
자료분석방법
수집된 자료는 유의수준 0.05로 하여 SPSS Window version 20.0 (IBM Corp., Armonk, NY, USA)을 이용하여 다음과 같이 분석하였다. 세 군간 일반적 특성 및 설문지, 수면 지표들은 빈도와 백분율, 평균과 표준편차로 제시하고, 각 군간의 차이는 범주형 변수는 Fisher’s exact test로 분석하였고, 연속형 변수의 경우에는 일원배치분산분석(ANOVA)을 시행하고, 사후 검정은 Scheffe test를 시행하였다.
결 과
세 군간 대상자의 일반적 특성 및 수면 설문지, ACT 검사결과 비교
분석대상 79명 중 OSSI군은 25명(31.6%)이었고, SSSI군은 36명(45.6%), NSDI군은 18명(22.8%)이었다(Fig. 1). 일반적 특성 중 나이가 세 군간 유의한 차이를 보였으며, 사후 분석 결과 SSSI군이 OSSI군보다 나이가 더 많은 것으로 나타났다. 대상자의 불면증 유병 기간은 유의한 차이를 보이지 않았다. 설문지 점수를 비교한 결과, PSQI는 OSSI군과 SSSI군이 NSDI군에 비해 점수가 높으며(p<0.001), ESS 점수는 OSSI군이 평균 7.64점으로 SSSI군의 4.36점보다 점수가 높은 것으로 확인되었다(Table 1).

Comparison of demographics, sleep questionnaires and actigraphy results according to insomnia type (n=79)
ACT 결과는 TIB, TST는 OSSI군이 다른 두 군보다 짧고, SE가 낮았으나, SOL과 WASO는 유의한 차이를 보이지 않았다. 수면시간 불일치는 SSSI군이 평균 2.74시간으로 가장 길었고, OSSI군은 0.96시간, NSDI군은 -0.39시간으로 사후 분석 결과 세 군간 모두 유의한 차이를 보였고, 오지각 지수도 세 군간 유의한 차이를 보였다(Table 1). 수면시간 불일치와 오지각 지수 분포는 Fig. 2와 같으며, SSSI군이 우측 편향을 보였다.
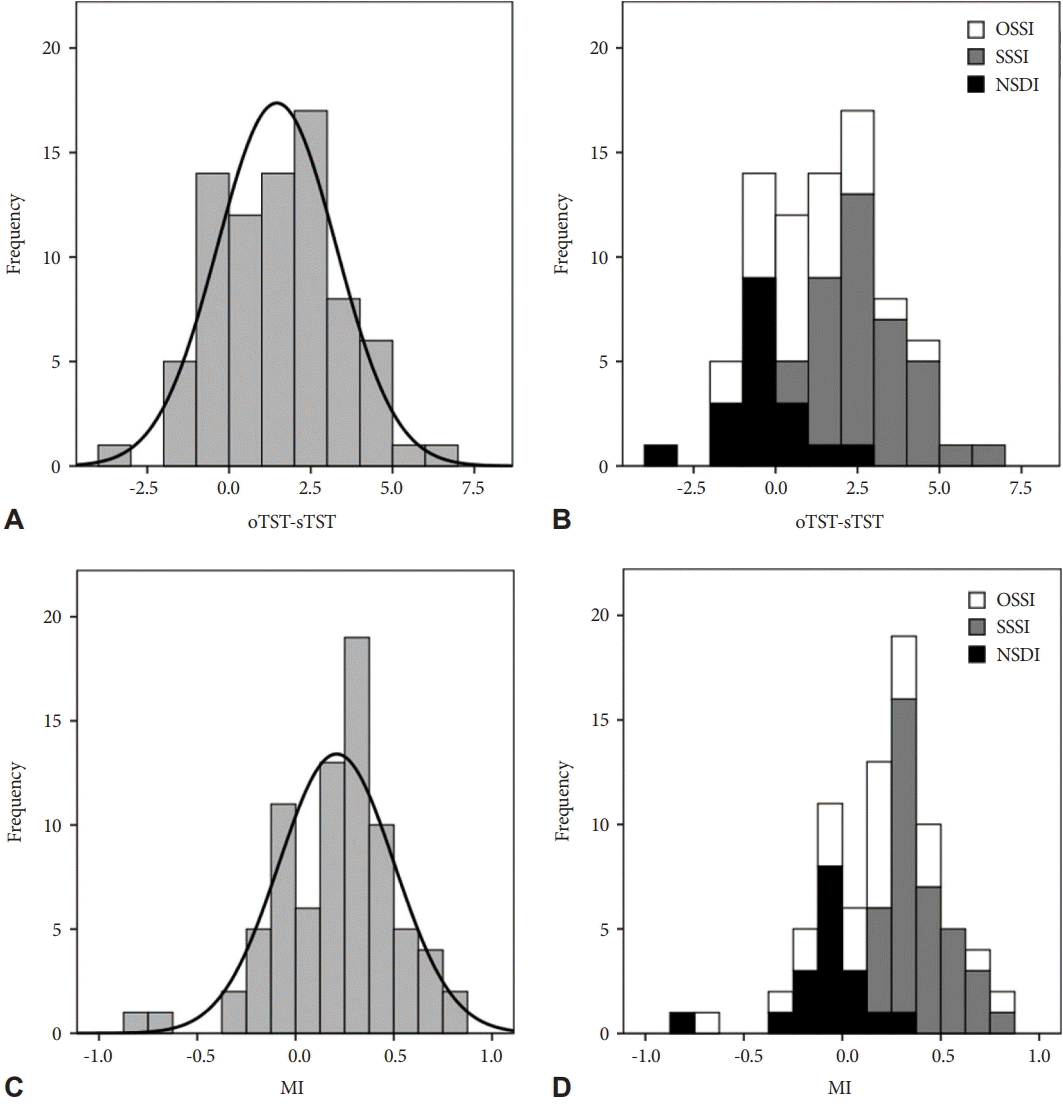
Distribution of the discrepancy of total sleep time (TST) (difference between objective TST [oTST] and subjective TST [sTST]) and Misperception Index (MI) in the subjects with chronic insomnia disorder in this study. The expected normal distribution is also shown (black line). A: Distribution of the discrepancy of TST in all subjects. B: Distribution of the discrepancy of TST in each group. C: Distribution of MI in all subjects. D: Distribution of MI in each group. OSSI, objective short sleep insomniacs; SSSI, subjective short sleep insomniacs; NSDI, normal sleep duration insomniacs.
세 군간 대상자의 수면다원검사 결과 비교
수면다원검사 결과를 비교한 결과 SOL, REM latency, N2 sleep %, REM sleep %가 군간 유의한 차이를 보였는데, 먼저 SOL은 OSSI군이 11.86분으로 NSDI군의 39.69분보다 유의하게 짧은 것으로 나타났다(p=0.004). 수면단계 중 N2 sleep %에서 OSSI군이 59.43%로 NSDI군의 67.96%보다 낮은 비율이었고, REM sleep %는 NSDI군이 15.47%로 OSSI군과 SSSI군보다 낮은 비율을 보였다(p=0.014). TST는 OSSI군이 6.17시간으로 SSSI군의 6.08시간, NSDI군의 5.90시간과 비교했을 때 유의한 차이를 보이지 않았다(p=0.681). 그 외 각성지수나 수면무호흡지수 등은 군 간 유의한 차이를 보이지 않았다. 수면다원검사 중 수면시간으로 인지한 시간은 세 군간 유의한 차이를 보이지 않았고, 모두 평균 5시간 미만인 것으로 보고하여, polysomnography 결과보다는 낮게 평가하는 것으로 나타났다(Table 2).
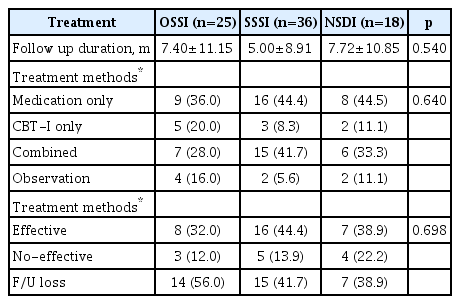
세 군간 대상자의 치료 방법 및 치료 효과 비교
세 군간 불면증 치료 방법을 비교한 결과 세 군 모두 약물치료만 선택한 경우가 36.0%-44.5%로 가장 많았고, CBT-I를 함께 한 경우가 28.0%-41.7%였으며, 세 군간 치료 방법에는 유의한 차이가 없었다. 치료 기간은 평균 5.00개월에서 7.72개월로 군 간 차이는 없었다. 추적기간 동안 치료 효과가 있다고 보고한 경우는 SSSI군이 44.4%로 가장 높았지만, 군간 유의한 차이는 없었다(Table 3).
고 찰
본 연구는 서울소재 일개 상급종합병원 신경과 수면 클리닉에 내원한 CID 환자들을 주관적 수면시간과 ACT로 측정한 객관적 수면시간의 특성에 따라 세 군으로 아형을 나누어 이들의 일반적 특성, 수면다원검사 소견, 치료적 특성의 차이를 비교하고자 시행하였고, 그 결과를 토대로 논의를 진행하고자 한다.
본 연구대상 CID 중 SSSI군이 45.6%로 가장 많은 빈도를 보였고, OSSI군이 31.6%, 주관적 수면시간이 6시간 이상이라고 평가한 NSDI군은 22.8%인 것으로 나타났다. 즉, 주관적 수면시간이 6시간 미만이라고 보고한 CID 중 객관적으로도 수면시간이 적은 것으로 확인된 OSSI는 41.0%로, SSSI의 빈도가 매우 높은 것을 확인할 수 있었다. 따라서 CID에서 객관적 수면시간을 평가하기 위해서는 ACT와 같은 장비를 이용해 평소 환경 하에서 수면시간을 파악할 필요가 있겠다. 인구통계조사인 국민건강영양조사결과 30세 이상 성인에서 주관적으로 보고한 수면기간(sleep duration)이 6시간 미만인 비율이 16.4%로 보고한 것과 비교했을 때[25], 본 연구 대상자는 77.2%가 주관적 수면시간이 6시간 미만인 것으로 보고 하고 있어 CID에서 주관적 짧은 수면 시간 비율이 현저히 높은 것으로 나타났다. 물론 국민건강영양조사는 WASO를 고려하지 않은 수면기간으로 측정되어 짧은 수면시간 빈도가 더 낮게 평가되었을 가능성이 높음을 고려해야 하지만, 그럼에도 CID에서 주관적 수면시간 평가는 매우 낮은 것으로 추정된다.
세 군간 인구학적 특성은 나이에서만 유의한 차이를 보였는데, SSSI군이 59.1세로 OSSI군의 50세에 비해 유의하게 많은 것으로 나타났다. 이는 1주간 ACT로 측정한 객관적 수면 시간과 수면일지로 측정한 주관적 수면시간간의 차이로 불면증 아형을 분류하였을 때 SSSI군에서 나이가 더 많은 경향을 보였던 네덜란드 연구와 유사한 결과이다[9]. 나이가 많을수록 수면의 연속성이 줄어들어 수면분절이 더 많아지기 때문에 실제 수면시간보다 더 적게 수면을 취한다고 인지할 가능성이 있다[26]. Harvey와 Tang [27]은 불면증에서 주관적 보고와 객관적 결과와의 불일치는 1) 수면을 기상으로 잘못 인식, 2) 수면과 관련된 위협에 대한 걱정과 선택적 집중, 3) 짧은 각성의 존재가 주된 메커니즘이라고 설명하였다. 그럼에도 수면을 저평가하는 역설적 불면증(paradoxical insomnia)에 대한 정의와 기전은 연구마다 다소 다르게 정의되거나 설명되기도 하였으며[28], 시간 예측 능력 저하, 잠에 대한 기억 왜곡, 뇌파에서 잡히지 않는 수면의 변화 등에 의한 것으로 주로 REM 수면 중에 수면 오지각이 발생한다는 의견도 있다[29]. 또한 수면부족에 대한 고정관념, 동반 정신장애 등이 영향을 주는 것으로 보고된다[30]. 본 연구에서 SSSI군의 주관적-객관적 수면시간의 차이는 평균 2.7시간으로 가장 길고 오지각 지수도 높은 것으로 나타났는데, 이러한 수면 오지각은 주관적으로 평가하는 수면의 질 변화에 의해 매개되므로, 수면 장애에 대한 인식의 정확성을 향상시키는데 집중하는 중재가 SSSI 환자를 위해 필요하다[31]. 또한 수면 오지각은 우울을 매개로 하여 주관적 불면증 심각도를 악화시킬 수 있다[32]. 본 연구에서도 SSSI군의 주관적 수면의 질이 NSDI군에 비해 유의하게 낮았으며, 비록 통계적 유의성은 없지만 우울 점수도 높은 것을 고려하면, 수면 오지각을 개선할 수 있는 인지치료가 포함된 CBT-I와 같은 중재를 좀 더 적극적으로 적용해 볼 필요가 있겠다.
본 연구에서 객관적 수면시간이 짧은 OSSI군은 ESS로 평가한 주간졸음 점수가 가장 높았으며, 통계적으로 유의하지는 않지만 과도한 주간졸음을 호소하는 빈도도 20.0%로 가장 많았다. 기존 연구들은 대부분 객관적 수면시간을 수면다원검사로 평가한 반면, 본 연구에서는 ACT를 통해 일상 환경 하에서의 평소 수면시간으로 평가하였고, ACT에서 1주간 평균 수면시간이 6시간 미만인 대상을 OSSI로 정의하였다. ACT가 수면다원검사에 비해 TST를 조금 더 과대평가함을 고려한다면[12] 대상자의 평소 객관적 수면시간은 ACT 평가된 것보다 더 적었을 가능성이 높다. 이러한 검사의 특성 때문에 CID 환자들의 아형을 명확하게 구분하는 것은 제한이 있지만, 본 연구의 OSSI군에서 ESS가 다른 군에 비해 높은 것으로 보고하고 있어 OSSI군이 불면으로 인한 주간기능장애가 좀 더 심함을 확인할 수 있었다. OSSI에서 대뇌피질의 과각성(cortical hyperarousal)은 청소년기부터 발현될 가능성이 높으며[33], Vgontzas 등[34]은 Penn State Cohort 자료를 분석한 결과 OSSI가 NSDI에 비해 평균 7.4년 후 추적조사 결과 불면증이 해결되지 않는 지속불면증(persistent insomnia) 발생률이 현저히 높다고 하였다. 비록 본 연구가 횡단적 조사이므로 이러한 특성을 조사할 수는 없었지만, 본 연구 대상자도 OSSI군의 나이가 다른 CID군에 비해 더 적은 것으로 나타나 이러한 선행연구의 OSSI 환자들의 특성과 유사한 것으로 해석할 수 있겠다.
그러나 검사실에서 시행된 수면다원검사에서, TST는 평균 5.9-6.17시간으로 세 군간 유의한 차이를 보이지 않았으며, 수면다원검사 종료 직후 보고한 주관적으로 인지한 수면시간은 4.35-4.50시간으로 세 군 모두 수면시간을 과소평가하는 것으로 나타나, 평소 환경에서의 수면시간보다 검사실에서의 수면시간에 대한 인식이 차이가 더 큰 것으로 나타났다. 또한 ACT 자료는 OSSI군이 SOL이 가장 길었으나, 수면다원검사 결과는 세 군 중 가장 짧은 것으로 조사되었으며, N2 sleep %가 낮고, REM sleep %는 높은 것으로 조사되었다. 이는 CID 환자의 객관적 수면을 평가하기 위해서 하루밤의 수면다원검사로는 1st night effect로 인해 환자의 특성을 파악하기 어려울 수 있음을 시사한다[35]. 수면 오지각은 ‘잘못된 인식(false perception)’이 아니고, 수면 중에 나타나는 정신활동(mental activity)을 수면다원검사나 ACT에서 파악하는데 어려움이 있어 각성으로 구분해 내지 못한다는 의견도 있다[9,36]. 최근 일주기유형과 뇌기능 장애에 대해 ACT 자료를 비모수적으로 분석하는 연구가 증가하고 있는데[37-39], 불면증 환자에서도 정상군과 비교해서 유의한 차이를 보이는지에 대한 연구도 시도되고 있다[40]. 향후 CID에서 수면 오지각을 설명할 수 있는 좀 더 다양한 연구들이 지속되어야 할 것이다.
대상자들의 치료 방법 및 결과를 살펴본 결과 세 군간 유의한 차이를 보이지 않았다. 세 군 모두 약물치료가 가장 많았고, 약물치료와 CBT-I 병합치료, CBT-I 단일치료 순으로 선택된 것으로 확인되었다. 본 연구가 후향적연구라 적극적으로 치료 방법을 선택할 수는 없었지만, 대상자의 의무기록검토 결과 대부분의 대상자에게 CBT-I가 권유 되었지만 대상자가 원하지 않아 약물치료를 유지하는 경우도 있었고, CBT-I를 선택한 경우도 치료 회기를 모두 마치지 않고 방문을 중단하는 경우도 많은 것으로 나타났다. 그러나 SSSI의 경우 환자가 지각하는 수면불일치에 대해서 객관적인 수면에 대한 정보와 수면교육만으로도 수면 오지각이 개선된다는 보고도 있으므로[41], 객관적 수면 자료를 확보하는 것은 치료에 중요한 방법 중 하나일 수 있다. 반면 OSSI의 경우 자율신경 반응과 같은 신체적 기전이 다른 불면증과 달라 CBT-I를 비롯한 치료 효과가 더 낮다는 보고가 있으나[6], 또 다른 연구에서는 OSSI군과 NSDI군 간 CBT-I는 동일하게 효과적이라는 보고도 있다[42]. 본 연구에서 치료 방법이나 치료 결과에서 세 군간 통계적 유의성은 없지만, OSSI군에서 대상자가 치료에 효과적이라 보고한 비율이 32.0%로 상대적으로 낮고, 치료 중단 비율이 56.0%로 더 많은 것으로 나타나 OSSI군에서 치료에 더 어려움을 느끼는 것으로 추정해 볼 수 있다. OSSI군이 다른 CID에 비해 고혈압, 당뇨병 등 동반질환 발생 위험이 더 높은 것을 고려한다면[8], 이들의 수면을 개선할 수 있는 보다 적극적인 치료 방법을 찾아볼 필요가 있다.
이상의 결과를 종합하였을 때, ACT로 객관적 수면을 평가한 OSSI군은 비교적 나이가 적고, 수면의 질이 나쁘고 주간 졸음이 더 심하나, 수면다원검사 상에서는 주목할만한 특성을 보이지는 않았다. 따라서 CID 환자의 객관적인 평소 수면시간을 파악하기 위해서는 ACT와 같은 장기간 수면을 모니터링 할 수 있는 장비로 검사를 할 필요가 있다. 최근 들어 ACT를 대신할 수 있는 스마트폰과 연동되는 다양한 consumer wearable sleep tracking device들이 개발되고 있으니, 이러한 기계들의 수면 측정 타당도가 확보된다면 보다 용이하게 객관적 자료를 얻을 수 있을 것이다. 향후 다양한 방법으로 CID의 수면 특성과 기전을 파악하는 후속 연구가 필요할 것으로 사료된다.
본 연구의 제한점은 주관적 수면시간을 매일의 수면일지로 조사한 것이 아니고 평소 수면습관을 묻는 단답형 질문으로 얻은 자료를 사용했기 때문에 기억 회상의 오류가 있다. 또한 일개 병원을 내원한 CID 환자를 대상으로 후향적 자료조사이므로, 치료 방법이나 효과를 보기 위해 집중적으로 중재하지 않아 CID 유형에 따른 치료 효과의 차이를 확인하는데 제한이 있다. 향후 CID 유형에 따른 치료 효과를 확인하기 위한 전향적 중재 연구를 제언한다.
Notes
The authors have no potential conflicts of interest to disclose.
Author Contributions
Conceptualization: Eun Yeon Joo, Su Jung Choi. Data curation: Su Jung Choi, Hyunjin Jo. Funding acquisition: Eun Yeon Joo. Investigation: Su Jung Choi, Hyunjin Jo. Methodology: all authors. Supervision: Eun Yeon Joo. Validation: all authors. Visualization: Su Jung Choi. Writing—original draft: Su Jung Choi. Writing—review & editing: all authors.
Funding Statement
This study was supported by Samsung Medical Center Grant (#OTC 1190671).