폐쇄성 수면무호흡증에 대한 표현형 접근
Phenotypic Approach to Obstructive Sleep Apnea
Article information
Trans Abstract
Obstructive sleep apnea (OSA), a common condition observed in clinical practice, is a significant public health concern; however, several patients with OSA remain underdiagnosed and untreated. OSA is not merely anatomically driven but is a heterogeneous disorder attributable to complex pathophysiology. Therefore, anatomically driven therapy such as continuous positive airway pressure (CPAP), dental device use, or upper airway surgery offers limited benefit because these approaches do not consider the various clinical and other pathophysiological contributors to OSA. Poor long-term adherence is a limitation of CPAP, the most effective modality recommended as first-line therapy in patients with OSA. Recent advances in our understanding of the pathophysiology and heterogeneity of OSA have led to the identification of three OSA phenotypes based on pathophysiological traits, polysomnographic traits, and clinical/symptom-based characteristics. In this review, we summarize recent progress and research trends in the phenotypic approach to OSA.
서 론
폐쇄성 수면무호흡증(obstructive sleep apnea, OSA)은 매우 흔한 질환으로[1,2], 수면 중 상기도의 반복적인 폐쇄 및 협착이 간헐적인 저산소혈증, 고이산화탄산혈증과 잦은 각성을 유발하여 수면의 질을 떨어뜨리고 다양한 주야간 증상을 초래한다[3]. 적절한 치료가 없으면 심혈관계 질환, 신경인지 감소와 주간 졸림을 유발하고 교통사고 위험을 높인다[3]. 무호흡-저호흡 지수(apnea-hypopnea index, AHI)는 5 이상으로 위스콘신 수면코호트에서 남성 24%, 여성 9%, AHI와 주간졸림증상을 동시에 고려할 때는 남성 4.5%, 여성 2%였다[4]. 국내 유병률은 AHI≥5 기준으로 남성 27%, 여성 16%, AHI≥5와 관련 증상을 고려할 때 남성 4.5%, 여성 3.4%로 추정된다[1]. 비만과 나이는 OSA의 주요 위험인자로 세계적인 비만 유행과 고령사회로의 진입으로 OSA 유병률은 증가하고 있다[5]. 가장 효과적인 OSA 치료는 양압치료(positive airway pressure)이다. 지속양압기(continuous positive airway pressure, CPAP)는 공기 펌프로 일정 압력을 양압 형태로 마스크를 통해 상기도에 끊임없이 전달하여, 양압이 상기도내 공기 부목(air splint) 역할을 수행하여 수면 중 발생하는 폐쇄를 방지, 저산소혈증과 잦은 각성을 막고 수면의 질을 높인다. 양압기치료 외에도 구강장치(oral appliance), 상기도 수술 치료(upper airway surgery), 체위치료(positional therapy), 위아래턱전진술(maxillomandibular advancement surgery), 체중감량 등 다양한 치료법이 있다. CPAP은 치료 효과에 비해서 낮은 환자의 순응도가, 그 밖의 방법은 치료 효과가 일관되지 않다는 문제가 있다[6,7]. 현재 대부분의 OSA 치료는 해부 요인을 해결하는 데 중점을 둔다[6]. CPAP은 상기도에 양압을 주입해서, 구강장치는 아래턱을 앞으로 내밀어서 해부 요인을 해결한다. 위아래턱전진술은 위턱과 아래턱을 앞으로 이동시켜 상기도를 넓힌다. 상기도 수술은 폐쇄를 유발하는 부위를 고정, 축소하거나 제거한다. 체위치료는 상기도의 구조적, 기능적 허탈을 최대한 줄일 수 있는 자세를 취해서, 체중감량은 연조직, 인두외벽, 혀에 축적된 지방을 감소시켜 수면 중 상기도를 넓게 유지하는 데 목적이 있다.
OSA의 병태생리에 대한 이해의 진전으로 OSA의 발병에는 해부요인 뿐 아니라 다른 생리요인도 영향을 끼친다는 것이 알려졌는데, 대표적인 3가지 생리요인은 1) 상기도 확장근 반응성 감소, 2) 루프이득(loop gain) 증가, 3) 각성역치(arousal threshold) 저하이다[8]. OSA 환자는 여러 해부생리 요인으로 인해 다양한 임상 특징과 치료 반응, 심혈관 결과를 갖는다[9-15]. 따라서 OSA 환자를 임상, 해부생리 특징에 따라 범주화 하려는 시도, 즉 표현형에 따른 접근법이 대두되고 있다[16]. Zinchuk 등[17]은 OSA의 표현형을 “OSA의 증상, 치료 반응, 건강 상태, 삶의 질과 같은 의미있는 임상적 속성과 관련된 질병 특징에 따라 구별되는 환자 범주”라고 정의하였다. 표현형은 해부생리요인, 증상, 인구요인, 동반 질환, 수면다원검사 특징을 중심으로 범주화되고 연구되고 있다. 이러한 관점은 임상적으로 OSA 환자의 치료 선택, 치료 반응 예측 및 장기 예후에 대한 새로운 통찰을 제공한다. OSA는 이질적인(heterogenous) 질환으로[16] OSA 환자 개인의 특성에 따라야 이상적일 것이다. 하지만 대부분의 OSA 환자에게 보통 한 두가지 치료만이 시도되는 경향이 있다. 본 종설에서는 OSA의 표현형에 대한 그간의 성과와 최근 연구 동향에 대해 정리하고자 한다.
본 론
해부생리특성에 따른 접근
해부요인
상기도 폐쇄에 영향을 미치는 해부 요인은 아래턱 크기, 단단입첩장(hard palate) 높이, 편도비대 등 매우 다양하다. 폐로부터 발생하는 흡기노력은 상기도 내 음압을 형성하며, 이때 상기도 근 긴장도가 떨어지면 폐쇄가 더 쉽게 발생한다. 특히 정상적으로 골격근 긴장도가 최대로 떨어지는 렘수면 중 더 심하다[18]. 상기도 근긴장도 저하는 체위 OSA 발생에도 중요한 원인이다[19]. OSA 환자에게 CPAP을 통해 적절한 치료압을 걸어주면 상기도 확장근 활성이 저하되는데, 이때 갑자기 압력을 낮추면 상기도 확장근 개입이 거의 없는 순수한 상기도 폐쇄압력(critical closing pressure, Pcrit)을 구할 수 있다[20]. 따라서 Pcrit은 상기도가 폐쇄되어 호흡기류가 중단되는 압력을 뜻하며 Pcrit이 높은 경우 상기도가 쉽게 폐쇄된다. 반대로 Pcrit이 낮을수록 폐쇄에 더 큰 음압이 필요하기 때문에 폐쇄에 대한 저항이 더 크다. Pcrit은 나이가 들면서 커지며, OSA 환자는 높은 Pcrit을 가져 구조적, 기능적으로 상기도 폐쇄성이 증가되어 있다[21]. 하지만 일정범위의 Pcrit에서도 상당한 AHI 차이를 보일 수 있어, 해부요인 외에도 비해부생리요인이 OSA 발생에 작용함을 예상할 수 있다.
비해부생리요인
상기도 확장근 반응성(upper airway dilator muscle responsiveness) 저하
상기도 확장근은 상기도의 압력민감 기계적감각수용기(pressure sensitive mechanoreceptor)와 화학수용기로부터 이산화탄소와 산소 변화에 따른 반사 신호를 받는다[22]. 상기도 확장근 중 가장 중요한 근육은 턱끝혀근(genioglossus muscle)이다. 대부분 OSA 환자에서 수면 중 인두 압력과 화학 자극에 반응하여 인두확장이 유지되지만 각성시 보다 더 강한 자극이 필요하다[6]. 상기도 확장근 반응성은 흉곽내 음압 변화에 따른 상기도 확장근의 활성을 뜻하며, 수면 중 상기도 확장근 반응성이 유지되어 있거나 증가된 경우에는 해부적 결함에도 무호흡 발생을 막을 수도 있다[23]. 30% 이상 OSA 환자에서 상기도 반응성이 감소되어 있다[21].
각성역치 저하
수면 중 호흡사건이 발생해서 가슴내 음압이 증가해 일정 수준에 도달하면 뇌의 각성이 발생하는데 이를 각성역치라 한다. 각성과 수면의 반복은 숙면을 방해하고 호흡을 불안정하게 하며 OSA를 악화시킬 수 있다. OSA 환자 대부분은 상기도 확장근을 활성화하는데 요구되는 자극이 각성을 유발하는데 요구되는 정도와 유사하다. 낮은 각성역치를 가진 OSA 환자는 낮은 자극에도 쉽게 깨어 확장근이 충분히 활성화될 기회가 줄어들게 된다. 따라서 잦은 각성은 상기도 확장근 활성을 떨어뜨리며[24] 불충분한 확장근 활성에도 불구하고 갑작스런 환기 증가를 초래하여 체내 이산화탄소의 감소를 유발하여 일부 환자에게 불안정한 호흡을 야기할 수 있다[25]. OSA 환자 약 30%-50%에서 작은 가슴내 음압 변화에도 쉽게 깨는 특성을 갖는다[21].
루프이득 증가
루프이득은 공학적인 피드백 개념을 인간의 호흡조절에 적용한 것으로, 수면 중 환기조절을 세 가지 구성요소, 1) 공장(plant): 폐, 혈액, 조직내 이산화탄소 저장상태, 2) 순환지연(circulatory delay): 이산화탄소 저장상태가 중추 화학수용기까지 도달하는데 걸리는 시간, 3) 제어기(controller): 이산화탄소 저장상태에 대한 중추에서 공장으로 보내는 반응으로 설명한다[26]. 루프이득은 환기 장애로 인한 이산화탄소 변화에 대한 제어기의 화학반응성(chemo-responsiveness)의 비(ratio)이다. 루프이득이 >1으로 증가된 경우 체내 작은 이산화탄소 변화에도 제어기가 민감하게 반응하여 매우 큰 환기 반응을 유발한다. 이러한 과민한 환기 반응은 심한 저탄산혈증을 유발하고 호흡구동(respiratory drive)과 상기도 확장근 활성을 떨어뜨려 호흡을 불안정하게 하고 상기도 폐쇄를 유발한다[25]. 루프이득이 작은 경우 이산화탄소 변화에 제어기가 적절하게 반응하여 과호흡 반응이 유발되지 않고 상기도 확장근 활성이 유지되어 안정적인 호흡이 가능하다. OSA 환자 약 30%가 큰 루프이득의 특성을 갖는다[21].
해부 요인에 의한 상기도 폐쇄성이 OSA 병태생리에서 가장 기본 요소이지만, 비해부적 특성이 기여하는 정도는 환자 마다 다르다[8]. 상기도 확장근의 반응성, 호흡 각성역치와 루프이득과 같은 특성들이 일부 OSA 환자들에게 해부 요인보다 중요할 수 있다. 루프이득은 수면다원검사를 통해서 얻은 데이터를 가공하고 분석하는 복잡한 과정을 통해서만 얻을 수 있다. 루프이득을 좀더 간단하게 측정하기 위해서 호흡중지(breath-holding) 방법 등이 고안되었으나[27] 아직 표준화되어 있지 않다. 수면다원검사를 통해 각성역치의 증가여부를 판단할 수 있는 수식도 고안된 바 있다. 각성역치가 낮은 경우 1) AHI<30, 2) 최소산소포화도 >82.5%, 3) 저호흡/무호흡 >58.3%의 특징을 갖는데, 3가지 조건 중 2가지 이상을 만족하면 낮은 각성역치로 추정 가능하다[28]. 또한 CPAP 치료압의 크기로 상기도 허탈성을 어느정도 추측 가능하다. Landry 등[29]은 Pcrit과 AHI 중증도와의 관계를 분석한 결과를 다음과 같이 제시하였다. 치료압이 ≤8 cmH2O인 경우 Pcrit<-2 cmH2O로 상기도 허탈성이 비교적 경미하고, AHI <40인 경우가 흔해서 Pcrit>2 cmH2O로 상기도 폐쇄성이 큰 경우는 3.7%에 불과했다[21]. 반면 치료압이 >8 cmH2O인 경우 상기도 허탈성이 크고, AHI>40으로 중증도가 심해서 Pcrit<-2 cmH2O인 10.3%에 불과했다[21]. 즉, CPAP 치료압이 ≤8 cmH2O인 경우 환자가 양압치료에 적응하지 못하거나 치료 거부시 양압치료 외 다른 생리 요인을 조절하기 위한 치료가 효과적일 수 있다. 더 쉽게 신뢰 가능한 표현형을 추정하고 이를 진료에 응용할 수 있도록 추가적인 전향적 연구가 필요하다.
수면다원검사결과에 따른 접근
지금까지 여러 연구를 통해서 밝혀지고 진료에서 이미 사용되는 대표적인 표현형 분류를 간략하게 살펴보면 다음과 같이 정리할 수 있다.
• 폐쇄무호흡 우세형: 전체 AHI에서 폐쇄무호흡이 90% 이상인 경우 Pcrit>2 cmH2O일 가능성이 높다. 상기도 폐쇄성이 크고 중증 OSA 환자에서 주로 나타난다.
• 일부 중추/혼합무호흡을 동반한 폐쇄무호흡 우세형: 대사 환기 조절이 불안정해서 상기도 폐쇄성이 크고 루프이득이 증가 경향을 보인다.
• 체위 OSA형: 바로 누운 자세에서 다른 자세에 비해 AHI가 2배 이상 크다. 수면 중 체위는 상기도의 폐쇄성과 상기도 확장근 활성에 영향을 준다. 바로 누운 자세에서는 무호흡이 더 자주 길게 나타나며 산소포화도 저하 또한 심하다. 바로 누운 자세에서 옆으로 누운 자세로 바꾸는 것으로도 Pcrit 4 cmH2O를 낮추어 상기도 반경을 좀더 안정되게 유지할 수 있다[19]. 양압치료에 실패하거나 순응도가 나쁜 경우 체위 OSA 환자에게 체위치료는 효과적인 대안이 될 수 있다. 여성에게는 드물다[30].
• 렘 우세 OSA형: 비렘 AHI와 렘 AHI의 비가 2보다 작다. 주로 여성에게 흔하며[30] 상기도 근육의 반응성이 떨어지고 루프이득이 낮다.
• 비렘 우세 OSA형: 비렘 AHI와 렘 AHI 비가 2보다 크다. 비렘수면시에는 환기 조절이 대사상태에 의존한다. 남성에서 흔하며 비렘수면시 불안정한 환기 반응이 나타나며 루프이득이 증가되어 있다. 비렘 AHI가 렘 AHI보다 25 이상 크면 보통 루프이득이 1보다 크다는 연구결과도 있다[31].
• 장기간 심한 저산소증 동반형: 각성역치가 증가되어 있으며 심한 저산소증에도 환기 반응이 떨어진다. 중증 OSA 환자에게 자주 보인다.
• 상기도저항증후군형: 호흡노력관련각성(respiratory effort related arousals)이 특징으로 Pcrit<-2 cmH2O 가능성이 높으며 상기도의 폐쇄성이 크지 않다.
임상특징에 따른 접근
OSA의 임상 아형에 따른 접근법을 우선 논하기 전에 가장 눈에 띄는 인구학적 특징은 남녀와 나이에 따른 구분일 것이다. 성별과 나이에 따라 OSA 임상증상, 해부생리요인, 치료에 대한 반응이 다르다.
성별과 나이에 따른 특성
여성은 생리 특성, OSA 중증도 및 OSA 증상 등 여러 측면에서 남성과 다른 특징을 갖는다[32-34]. 여성 OSA 환자가 남성에 비해 상기도의 길이가 짧고[35] Pcrit이 낮아 상기도 폐쇄성이 떨어진다. 지방 분포에서도 남녀 차이가 있으며[36] 화학 자극에 따른 환기 반응성도 떨어진다[37]. 이는 폐경 전 여성에서 여성호르몬이 턱끝혀근의 활성을 증가시키고 황체호르몬(progesterone)이 호흡을 촉진하는 효과가 있기 때문이다[38]. 이러한 특성은 한국인 여성 OSA 환자 대상 연구에서도 확인되었다. 여성에서 OSA 환자가 더 나이가 많았고 OSA 중증도는 남성보다 덜 하나 70세 이후에는 중증도 차이가 없었다[34].
남성에 비해서 코골이, 무호흡과 주간 졸림과 같은 OSA에서 특징적인 증상은 적은 반면, 아침 두통, 우울감을 더 자주 호소하며, 수면에 들기 어렵거나, 자주 깨거나, 이른 아침에 일어나는 불면증 증상 등 비특이 증상 호소가 잦다[33]. 하지만 우리가 임상에서 사용하는 OSA 감별 설문들은 전형적인 남성 OSA 환자 특징에 초점을 맞추어서 개발되었다. 따라서 여성에서 나타나는 임상 특징을 고려한다면 여성에 맞춘 OSA 감별 설문 개발이 필요하다[39].
여성에게 렘 우세 OSA형이 자주 나타나는데[30] 렘 우세 OSA형은 고혈압 발생률이 높으며[10] non-dipping과 관련 있고[9] 장기간 혈당 조절에 영향을 미친다고[11] 알려져 있다. Sleep and Health in Women 코호트 연구에서 렘수면 중 반복적인 무호흡이 10년간 추적관찰 시 뇌혈관 질환 발생 위험을 대변하는 경동맥 내막 두께(intima thickness) 증가와 관련되었으며[12], 심혈관계 질환의 위험이 큰 군에서 복합 심혈관계 사건 위험을 높였다[15]. 여성의 경우 양압기치료 순응도가 남성에 비해 떨어지는 것으로 알려져 있으나 연구에 따라 일관된 결과를 보이지 않는다[40-42]. 렘 우세 OSA가 여성에게 흔하다는 점을 고려한다면 양압기치료에서 일반적으로 권유되는 4시간 이상의 치료 기준은 렘 수면이 보통 수면의 후반기에 집중되기 때문에 여성에게 충분치 않을 수 있다[9]. 여성 OSA 환자는 나이, 폐경 여부, 증상, 렘 우세 OSA 여부, 심혈관계 질환 여부, 양압기치료 순응도 등에서 남성과 구별되는 특징이 있다[33].
나이가 들수록 해부학적으로 취약해지며 턱끝혀근 활성이 감소하여 OSA 유병률은 증가한다[43]. 보통 나이가 들면서 수면 중 더 자주 각성이 일어난다고 알려져 있으나, 최근 연구에 의하면 각성역치는 나이에 따라 큰 변화가 없었으나 루프이득은 감소하였다[44]. 동반 질환 유병률이 높은 노인에게서 양압기치료는 특히나 중요하다.
임상 특징에 의한 분류
OSA의 표현형을 분류하는데 있어서 가장 많이 연구된 바는 증상에 따른 분류다(Table 1). 대표적인 연구가 Iceland Sleep Apnea Cohort 연구이다. 연구에서는 중등도 이상(AHI ≥15) OSA 환자 822명을 ‘과다졸림형(excessive sleepiness)’, ‘수면장애형(disturbed sleep)’, ‘최소증상형(minimally symptomatic)’의 3가지 증상군으로 구분하였다[45]. 과다졸림형(42%)은 가장 연령대가 낮으며 전형적인 OSA의 임상 특징을 갖는데, 엡워쓰졸림점수가 가장 높고 졸음 운전의 비율이 높았다. 수면장애형(33%)은 주로 불면증상, 비회복수면 등을 호소였으며, 최소증상형(25%)은 가장 연령대가 높았으며, 자주 깨고, 코골이와 무호흡이 배우자의 수면을 방해하지만 졸림이나 불면증상은 적은 특징을 보였다. 이러한 임상 아형은 국제 수면 코호트에서도 역시 재현되었으며[46], 국내 연구에서도 3군간 분포의 차이는 있었지만 이러한 분류가 유효하다고 입증되었다[47]. 이 분류는 OSA의 중증도(AHI)와 무관하다는 점, 전형적인 주간 졸림 증상은 일부 환자군에만 나타난다는 점, 최소증상형이 가장 연령대가 높고 이로 인해 노년까지 OSA 진단이 늦춰질 위험이 있다는 점에서 중요한 통찰을 제공한다[48]. 그 밖에도 각종 인체 측정치, AHI, 동반 질환 등 다양한 임상 특징을 조합하여 분류하려는 노력이 있으나, 각 연구에 따라 상이한 분류기준으로 아직 임상에서 적용하기에는 무리가 있고, 3가지 임상 아형이 비교적 분류가 쉽고 적용하기 쉬어 보인다. Mazzotti 등[13]이 Sleep Heart Health Study에서 중등도 이상 OSA 환자 1,207명을 대상으로 증상에 따라 수면장애형, 최소증상형, 과다졸림형, 증등도 졸음형의 4가지 임상 아형으로 분류하여 심혈관계 질환의 유병과 발병의 연관성을 평가하였을 때, 과다졸림형이 통계적으로 유의하지는 않지만 다른 군에 비해 3배 이상 심부전 유병률이 높았다. 각 아형분류는 심혈관질환 발병과 관련되었으며, 특히 과다졸림형에서 심혈관질환 발생위험이 가장 높았다. 이런 결과는 임상 특징에 따른 분류가 심혈관질환과 연관되어 있고, 심혈관질환의 위험을 대변할 수 있음을 보여준다. 하지만 기존 연구 대부분 연구대상자에서 여성 OSA 환자의 비율이 낮았기(<30%) 때문에 여성 OSA 환자에 대해 추가 연구가 필요하다(Fig. 1).
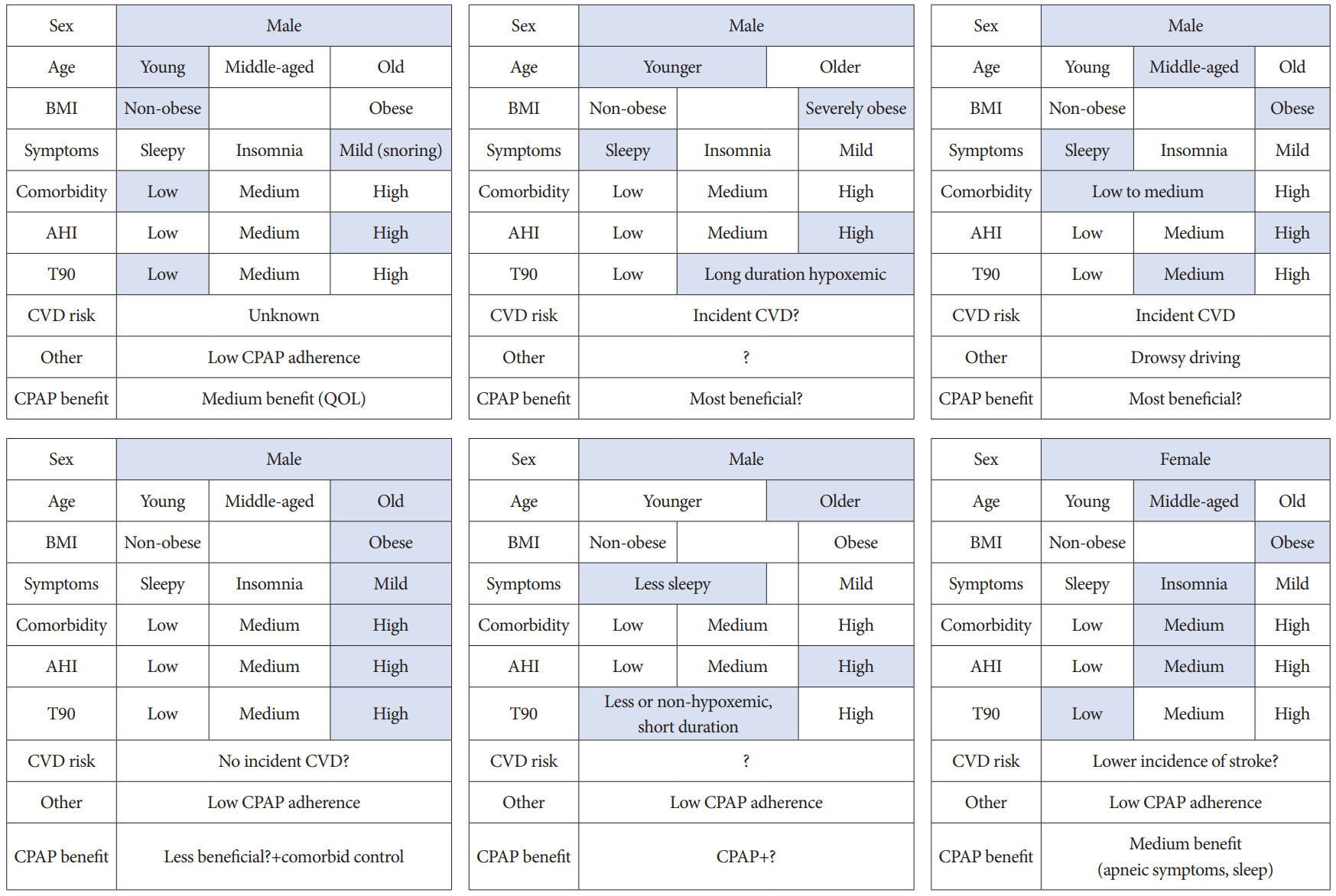
Obstructive sleep apnea clinical subtypes focused on demographic characteristics, anthropometrics, comorbidities, symptoms and polysomnographic findings. Further study should be focused on female patients. AHI, apnea-hypopnea index; BMI, body mass index; CPAP, continuous positive airway pressure; CVD, cardiovascular disease; T90, time with oxygen saturation <90%; QOL, quality of life.
AHI를 벗어난 새로운 접근
AHI는 OSA를 진단, 질병 중증도 분류, 유병률 연구, 치료와 치료 성과 확인 및 예후를 평가하는 기본 요소로, 산소포화도 저하, 수면분절 등 관련 인자들과 중등도 이상 연관을 갖는다[49]. 수면 기간 중 발생한 총 무호흡과 저호흡 횟수를 수면시간으로 나눈 AHI는 이해하기 쉽고 검사를 통해 쉽게 구할 수 있다. 하지만 이 단순성은 역으로 AHI의 한계가 된다. AHI는 호흡사건의 기간과 정도를 반영하지 못하고 각성 역치, 호흡반응, 수면분절을 직접적으로 대표하기에는 부족하다. 3가지 임상 아형을 통한 분류 시 각 군간 AHI 차이가 없었다는 점은 시사하는 바가 크다. 최근에는 이러한 AHI의 단점을 극복하기 위해서 수면다원검사에서 얻어지는 여러 신경생리학적 신호를 바탕으로 새로운 해석이 시도되고 있으며, 대표적인 접근법이 OSA에서 동반되는 산소포화도 저하에 대한 정량화 시도이다. 전통적인 정량화 방법으로는 기저치에서 3% 또는 4% 이상 산소포화도가 저하된 총횟수를 수면시간으로 나눈 산소불포화지수(oxygen desaturation index), 수면 중 산소포화도 90%, 80% 미만 시간을 나타내는 T90과 T80, 최저산소포화도 등의 방법이 있다. 이런 방법들은 AHI 만큼이나 구하기 쉬우며 간단하나 1) 산소포화도 저하의 원인이 OSA뿐만 아니라, 만성폐쇄성폐질환, 만성기관지질환, 신경근육질환 등 다양하고, 2) 산소포화도 저하를 규정하는 3%, 4% 절단값이 작위적이며, 3) 병태생리에 대한 고려 없이 단순히 저산소혈증 중증도를 수치화 하는 것에 불과하다는 단점이 있다. 최근 obstructive severity [50], hypoxia load [51], hypoxic burden [14] 등은 호흡사건 길이, 호흡사건 정도, 호흡사건 관련 산소포화도 저하와 산소포화도 정상화, 호흡사건 등을 고려하여 이러한 단점을 극복하려 하고 있다. Hypoxic burden을 이용하여, Sleep Heart Health Study, Osteoporotic Fracture in Men Study의 코호트를 대상으로 hypoxic burden이 심혈관 관련 사망률을 예측할 수 있음을 보여주었다[14]. 그 밖에도 시계열 데이터의 예측 불가능성과 규칙성을 정량화하는 통계 수법인 근사 엔트로피(approximate entropy)를 심박동수, 산소포화도, 호흡 등에 적용하거나[52], 뇌파 스펙트럼 분석을 통한 자동화된 수면깊이(sleep depth) 측정법인 odds ratio product [53] 등 다양한 방법이 시도되고 있다.
표현형에 따른 표적치료
여태까지 OSA의 다양한 병태생리적, 임상 특징을 통해서 의미 있는 속성과 관련된 질병 특징으로 환자를 범주화 하려는 노력, 즉 표현형에 따른 접근에 대한 그간의 성과와 현황에 대해 알아보았다. 하지만 이러한 노력들이 연구성과로만 국한되어서는 안되며 실제 임상진료에 적용되어야 의미가 있다.
기존의 치료는 Pcrit으로 대변되는 상기도 폐쇄성을 막는 방법에 중점을 두고 있다. OSA의 3가지 중요 생리적 특성인 상기도 확장근 반응성, 각성역치, 루프이득을 조절하기 위해서는 다음과 같은 치료가 시도되고 있다. 상기도 확장근 기능을 강화하기 위해서는 아직 국내에서 시행되지는 않지만 FDA 허가를 받은 혀밑신경자극술(hypoglossal nerve stimulation) [54]과 들숨근육강화훈련(inspiratory muscle training) [55], 실험적 약물 치료[56]가 시도되고 있다. 각성역치 조절을 위해서는 일부 각성역치가 낮은 OSA 환자에게 eszopiclone, zopiclone, zolpidem 등 일부 수면제를 사용해서 각성역치를 높이는 방법이 시도되고 있고[57], 루프이득을 조절하기 위해서는 대표적으로 산소치료[58], 탄산탈수효소억제제(carbonic anhydrase inhibitor) [59], enhanced expiratory rebreathing space [60]의 사용을 고려할 수 있다. Enhanced expiratory rebreathing space는 CPAP 치료 시 사강(dead space)을 늘여서 이산화탄소 재호흡을 통해 불안정한 호흡을 안정시키는 방법이다[60]. 양압기치료에 낮은 순응도를 보이는 환자에게 이러한 생리학적 특성을 겨냥한 보조 치료가 순응도를 높이고, 무호흡의 중증도를 개선하는 데 효과적일 수도 있으며, 치료에 실패하거나 거부하는 환자에게 개별적인 2가지 이상의 생리특성을 조절하기 위한 복합치료가 효과적일 수도 있어서 관련 연구가 필요하다.
이론적으로는 Pcrit이 낮은, 즉 해부학적인 상기도 폐쇄성이 정상이거나 정상에 가까운 OSA 환자에게는 기존 CPAP 치료 없이 3가지 생리학적 특성을 치료 목표로 삼아도 치료가 가능할 수 있다. 더욱이 병태생리학적 기전에 따른 치료 전략에 나이와 남녀 성별에 의한 특성과 임상양상에 따른 OSA 아형 분류까지 함께 고려한다면, OSA 환자 개개인의 특성에 맞는 치료와 그 치료 반응에 대한 예측이 어느정도 가능하다.
결 론
수십년간 OSA에 대한 병태생리 기전이 밝혀지고, 다양한 치료 접근법 개발 등 OSA를 이해하고 치료하는 데 뚜렷한 성과를 이루었다. 하지만 지금까지 OSA에 대한 병태생리 기전에 따라 치료 전략을 세우고 전향적으로 치료가 시도되어 성과가 확인된 바는 없다. OSA 표현형에 대한 새로운 접근법은 아직 해결되지 않은 많은 문제들이 남아있다. 3가지 표현형으로 대표되는 OSA 임상양상에 따른 분류만 해도, 경증의 OSA 환자에게도 3가지 표현형이 일관되게 존재하는지, 그 분류가 유효한지, 각 표현형에 따라 장기적 예후가 다를 것인지, 표현형이 시간경과에 따라 어떻게 변화하는지, 이러한 표현형 분류가 OSA 병태생리와 어떻게 연결되는지, 이 분류가 실제 임상 환경에 적용하기에 유용한지, 분류에 따라 OSA 치료 순응도에 어떤 차이가 있고 그것이 치료 결과에 어떠한 영향을 주는지 등 다양한 의문이 남아있다. 또한 OSA의 생리특성에 따른 접근법과 수면다원검사에서 얻는 다양한 생리신호를 분석해서 AHI의 한계를 극복하려는 시도들은 이를 구하는 과정이 복잡하여 아직까지는 실제 진료에서 적응하기는 어렵다. 각각의 생리신호들은 OSA의 다양한 얼굴을 보여주고, 일부 AHI 보다 OSA 관련 임상결과를 더 잘 예측 가능하게 하지만, 아직 OSA의 총체적인 모습을 통합해서 조망하지는 못하는 한계가 있다.
OSA는 단순한 해부학적 질환이 아니다. OSA 환자를 평가하고 치료할 때 상기도 폐쇄의 해부요인 제거만을 목적으로 한다면 병력청취, 간단한 설문, 신체 진찰과 간이이동수면검사(out-of-center sleep test)로 OSA를 진단하고 자동양압치료기(auto PAP), 구강장치나 수술 치료를 제공하는 것으로도 충분할 것이다. 하지만 임상에서 이미 우리는 환자 증상을 여러 설문을 통해서 다각적으로 평가하고, 가족력, 동반 질병 상태, 사용 약물을 확인하고 해부요인을 측정한다. 또한 수면다원검사를 통해 여러 생리신호를 얻어내고 해석하는데 많은 시간과 노력을 들이고 있다. 이는 OSA 환자 개개인의 다양한 특성을 고려하고 다학제접근(multidisciplinary approach)을 통해 환자에게 최적의 치료를 제공하기 위함이다. 앞으로도 실제 진료현장에 쉽게 적용 가능한 방법에 대한 연구가 지속되어야 하며, 이러한 노력이 OSA 환자 개인 특성에 따른 치료 맞춤화를 앞당기고, 최선의 치료 결과를 보장할 수 있을 것이다.
Notes
The author has no potential conflicts of interest to disclose.
Funding Statement
None

