비만대사수술 시행 환자에서 수면무호흡증의 대사영향 평가에 대한 연구
Metabolic Effect of Obstructive Sleep Apnea in Patients Undergoing Bariatric Surgery
Article information
Trans Abstract
Objectives
The prevalence of obstructive sleep apnea (OSA) and its association with perioperative comorbidities in patients who undergo bariatric surgery remain unclear in South Korea. We investigated the prevalence of OSA and its association with metabolic parameters in patients who underwent bariatric surgery.
Methods
This retrospective study included 144 patients who underwent bariatric surgery; 98 patients underwent a sleep study and were included in this study. Patients were categorized into two groups based on the apnea-hypopnea index (AHI) cut-off value of 15/hour.
Results
Overall, 52 (53.1%) of the patients showed an AHI ≥15/hour. The neck circumference was larger (43.0±4.7 cm vs. 40.5±3.6 cm, p=0.005) and prevalence of diabetes was higher (65.4% vs. 45.7%, p=0.049) in patients with AHI ≥15/hour than in those with AHI <15/hour. Furthermore, fasting blood glucose levels were higher (134.7±50.5 mg/dL vs. 114.8±34.3 mg/dL , p= 0.028) and serum high-density lipoprotein levels were lower (46.8±9.9 mg/dL vs. 52.8±13.3 mg/dL, p=0.013) in the AHI ≥15/hour than in the AHI <15/hour group.
Conclusions
More than 50% of patients who underwent bariatric surgery had moderate-to-severe OSA. The prevalence of metabolic comorbidities was higher in those with moderate-to-severe OSA than in those without. OSA screening may be useful for evaluation of the metabolic complications of morbid obesity.
서 론
비만은 전 세계적으로 약 6억 5천만 명이 가지고 있는 중요한 건강 문제이다. 비만은 고혈압, 당뇨병, 뇌졸중과 같은 대사성질환 및 암과 같은 다양한 만성질환의 위험 인자이며 조기 사망 및 장애의 원인이 되기도 한다[1]. 비만 환자에서 폐쇄성 수면무호흡증(obstructive sleep apnea, OSA)이 흔히 동반되며 중등도 이상의 OSA는 대사성질환의 악화 요인으로 알려져 있다[2,3].
OSA는 수면 중에 기도가 완전히 혹은 부분적으로 폐쇄되는 것이 특징이다. OSA의 위험인자에는 비만이 있으며, 비만과 OSA 사이에는 선형 상관관계가 있다[4]. 비만인 사람들의 경우 상부 호흡기에 지방이 축적되면 기도가 좁아지고, 이 부위의 근육 활동이 감소하여 저산소증 및 무호흡 증상이 나타나게 되며, 궁극적으로 수면무호흡이 발생한다[5]. 성인 인구 중 OSA의 유병률은 25% 정도로 알려져 있으나, 비만환자에서 OSA의 유병률은 45%까지 보고되고 있다. 비만은 OSA를 유발하고 악화시킬 수 있다[6]. OSA는 또한 저산소증, 고이 산화탄소혈증, 잦은 수면각성, 수면박탈을 일으켜 산화 스트레스, 염증반응, 교감신경계 항진을 유발하여 대사질환 및 심혈관 질환의 위험도를 증가시키는 것으로 알려져 있다[7-11].
비만대사수술은 우리나라에서 체질량지수(body-mass index, BMI) 35 kg/m2 이상인 고도비만이거나, BMI 30 kg/m2 이상이면서 고혈압, OSA, 관절질환, 위식도역류, 제2형당뇨, 고지혈증, 천식 등 대사와 관련된 합병증을 동반한 경우 요양 급여 적용 대상이 된다[12]. 비만대사수술은 체중 감소의 장기적인 유지와 관련된 비만 치료의 가장 효과적인 방법으로 알려져 있다[13]. 2019년도에 나온 비만대사수술 전후 관리에 따른 가이드라인에 따르면, 비만대사수술 환자는 수술 전 수면무호흡증에 대해 임상적 선별검사를 시행하여, 만약에 선별검사에서 양성이라면, 수면다원검사를 시행하는 것을 권고한다[14]. 하지만, 국내 비만대사수술을 시행하는 환자에서 OSA를 동반하는 빈도와 OSA가 대사질환에 미치는 영향 평가는 부족한 실정이다.
본 연구에서는 강동경희대학교병원에서 비만대사수술을 시행한 환자들을 후향적으로 분석하여 비만대사수술 대상인 환자들에서 OSA 동반 비율을 확인하고, 중등도 이상의 OSA가 이 환자들에서 대사지표와 대사증후군에 미치는 영향을 평가하고자 한다.
방 법
대 상
2019년 1월 1일부터 2021년 10월 30일까지 강동경희대학교병원 외과에서 비만대사수술을 시행한 환자의 의무기록과 검사결과를 후향적으로 분석하였다. 그중 OSA 평가를 위해 수면다원검사 또는 이동식 수면검사장비 ApneaLinkTM (ResMed, San Diego, CA, USA) 검사를 수술 6개월 내에 시행한 환자를 포함하였다.
본 연구는 강동경희대학교병원 임상시험심사위원회(IRB)의 승인을 받은 시험계획서(IRB 승인번호: 2019-07-011)에 따라 진행하였다.
자료 수집
강동경희대학교병원 전자의무기록에서 비만대사수술을 시행한 환자들의 임상적 특성에 대한 기록을 후향적으로 분석하였다. 의무기록에서 대상자 나이, 성별, 수축기혈압, 이완기혈압, BMI, 목둘레, 허리둘레, 동반 질환(고혈압, 당뇨, 고지혈증, 심혈관질환과 대사증후군) 유무를 파악하였다. 의무기록 혹은 수면다원검사 전 시행한 설문지에서 동반 질환을 앓고 있음이 파악되었거나, 전자의무기록 관련된 약을 처방받은 경우를 동반 질환이 있는 것으로 정의하였다.
수면검사
OSA 유무는 수면다원검사 또는 ApneaLinkTM 결과를 통해 조사하였다. 수면 검사를 진행한 환자들 중 대부분은 처음 내원 시 STOP-Bang 설문조사 결과 3점 이상인 사람이었다. ApneaLinkTM와 수면다원검사는 담당 의사 의견과 환자 및 보호자 동의 여부에 따라 진행하였다. 수면다원검사결과 또는 ApneaLinkTM 검사결과 무호흡-저호흡 지수(apnea-hypopnea index, AHI)가 5/hr 미만인 경우 수면무호흡이 없는 것으로, 5에서 14.9/hr인 경우 경도, 15에서 29.9/hr까지를 중등도, 30/hr 이상을 심한 수면무호흡이 있는 것으로 정의하였다.
혈액검사
수면검사 시행 전 2달 이내 시행한 혈액검사결과를 조사하였다. 조사항목은 혈중 당화혈색소(HbA1c), 인슐린, 포도당, 콜레스테롤, 중성지방(triglyceride, TG), 고밀도 콜레스테롤(high-density lipoprotein, HDL), 저밀도 콜레스테롤(lowdensity lipoprotein)이었다. 또한 2001년 NCEP ATP III 지침에 따른 대사성 증후군[15]의 비율을 조사하였다.
통계학적 분석
연속자료는 평균±표준편차의 양식으로 표기하였으며, 범주형 자료는 퍼센트와 절대수치를 이용하여 표기하였다. 수면다원검사 또는 ApneaLinkTM 결과에서 AHI 15/hr를 기준으로 두 군으로 나누어 변수들의 평균과 비율을 비교하였다. 두 검사를 모두 시행한 환자에 대하여 일치도를 확인하기 위하여 급내상관계수(interclass correlation coefficient)를 사용하였다. 연속형 변수의 경우 정규성 검정을 만족할 때 twosample t-test를 시행하였으며, 정규성 검정을 만족하지 않는 경우 Mann-Whitney 검정을 시행하였다. 범주형 자료는 Pearson χ2 검정을 이용하여 분석하였다.
연구자료는 SPSS (ver. 28.0.1.1; IBM Corp., Armonk, NY, USA)를 사용하여 분석하였으며 p<0.05인 경우 통계학적으로 유의미한 것으로 판단하였다.
결 과
임상적 특성
2019년 1월 1일부터 2021년 10월 30일까지 비만대사수술을 시행한 144명의 환자 중 102명(70.8%)이 수술 전 OSA 동반 여부 확인을 위한 수면검사를 시행하였다. 이 중 4명은 수면검사 자료를 얻을 수 없어 연구에서 제외하였으며, 98명을 최종 분석 대상으로 선정하였다(Fig. 1). 수면검사를 시행한 군과 수면검사를 시행하지 않은 군을 비교했을 때, 수면검사를 시행한 군에서 목둘레가 더 컸으며(41.82±4.39 cm vs. 39.23±3.32 cm, p=0.003) 당뇨 유병률이 더 높았다(56.1% vs. 34.1%, p=0.018) (Supplementary Table 1 in the online-only Data Supplement).
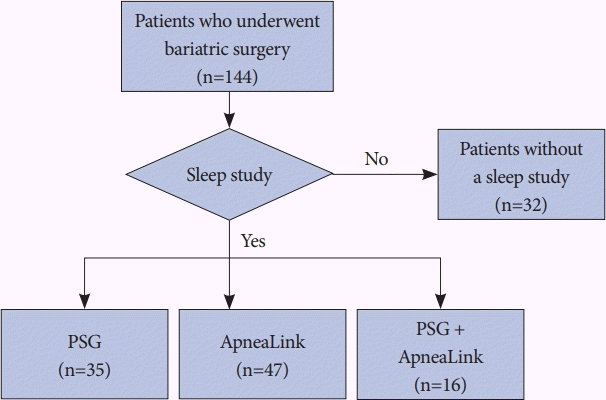
Flow diagram of the study participants. Among 144 patients who underwent bariatric surgery; 98 patients underwent a sleep study and were included in this study (4 were excluded due to no records). PSG, polysomnography.
대상자 98명의 평균 나이는 45±12세였으며, 그중 48명(49.0%)은 남자였고, 평균 BMI는 37.4±5.7 kg/m2였다. 대상자 중 고혈압은 62명(63.3%), 당뇨는 55명(56.1%), 고지혈증은 49명(50%)으로 확인되었다. 고혈압, 당뇨, 고지혈증을 모두 가지고 있는 환자는 28명(28.6%)이었다(Table 1).
OSA 유병률
대상자 중 51명(52.0%)이 수면다원검사를 시행하였고 63명(64.3%)이 ApneaLinkTM 검사를 시행하였다. 수면다원검사 또는 ApneaLinkTM에서 AHI 5/hr 이상의 OSA가 동반된 환자가 79명(80.6%)이었고, 중등도 이상 OSA (AHI≥15/hr)가 확인된 대상자는 총 52명(53.1%)이었다. 수면다원검사를 시행한 대상자 중에서 OSA는 총 49명(96.1%)에서 확인되었으며, 그중 경증은 8명(16.3%), 중등도는 8명(16.3%), 중증은 33명(67.3%)이었다. ApneaLinkTM 시행한 대상자 중에서 OSA는 총 47명(74.6%)이었으며, 그중 경증은 22명(46.8%), 중등도는 12명(25.5%), 중증은 13명(27.7%)이었다. 이 중 16명(16.3%)은 두 검사를 모두 시행하였으며 수면다원검사와 ApneaLinkTM의 급내상관계수는 0.182 (p=0.317)로 높지 않았지만, 중등도 이상 수면무호흡증을 분류하는 것은 2명을 제외한 모든 환자에서 두 검사가 일치하였다.
중등도 이상 OSA 환자에서 임상적 특성 차이
중등도 이상 OSA를 동반한 군에서 그렇지 않은 군에 비해 나이 차이는 없었으나 남자 비율이 더 많은 경향성이 있었다(57.7% vs. 39.1%, p=0.067). 또한 AHI≥15/hr로 확인된 군에서 AHI<15/hr군에 비해 목둘레가 더 컸으며(43.0±4.7 cm vs. 40.5±3.6 cm, p=0.005), 당뇨병 유병률이 더 높았다(45.7% vs. 65.4%, p=0.049). 수면평가를 위해 수면다원검사는 중등도 이상 OSA 환자군에서 더 많이 시행하였으며(80.4% vs. 19.6%, p<0.001), ApneaLinkTM는 경도 이하 OSA 환자군에서 더 많이 시행하였다(60.3% vs. 39.7%, p<0.001) (Table 1).
중등도 이상 OSA 환자에서 대사지표 차이
혈액검사결과 결과, 중등도 이상 OSA 환자에서 그렇지 않은 환자에 비하여 혈중 포도당이 증가되어 있었으며(134.7±50.5 mg/dL vs. 114.8±34.3 mg/dL, p=0.028), HDL은 감소되어 있었다(46.8±9.9 mg/dL vs. 52.8±13.3 mg/dL, p=0.013). 중등도 이상 OSA에 따른 혈중 포도당과 HDL 변화는 공분산분석을 이용하여 나이, 성별, 당뇨병 유무를 보정한 후에도 유의하였다(각각 adjusted p=0.043, 0.036). 또한 AHI≥15/hr로 확인된 군에서 AHI<15/hr 군에 비해 HbA1c가 상승된 경향을 확인하였다(6.8%±1.4% vs. 6.3%±1.2%, p=0.094). 또한 NCEP III 지침에 따른 대사성증후군의 비율은 전체 85.7%였고 중등도 이상 OSA 군에서 92.3%, 경도 이하 군에서 78.3%로 두 군 간 통계학적으로 유의미한 차이가 확인되었다(p=0.047) (Table 2).
고 찰
비만대사수술을 시행한 144명 중 수면검사를 시행한 98명을 분석한 이 후향적 연구에서 OSA는 79명(80.6%)이었으며 그중 중등도 이상 OSA는 52명(53.1%)으로 확인되었다. 중등도 이상 OSA가 동반된 군에서 그렇지 않은 군에 비해 목둘레가 더 컸으며, 당뇨병의 유병률도 높았다. 혈액검사 결과 중등도 이상의 OSA가 동반된 그룹에서 혈중 포도당 농도가 높았으며 HDL이 감소되었다. 대사성증후군 비율은 중등도 이상 OSA군에서 그렇지 않은 군보다 높았다.
본 연구에서 비만대사수술 대상 환자 중 80% 이상에서 OSA가 확인되었으며 절반 이상에서 중등도 이상 OSA가 확인되었다. 외국의 한 연구에서 137명의 비만수술 대상자를 미국수면학회 기준에 따라 분류했을 때 정상이 32명(23.4%), 경도 OSA가 37명(27.0%), 중등도 OSA가 37명(27.0%) 및 고도 OSA가 31명(22.6%)으로 보고되어 본 연구와 유사하였다. 하지만 BMI를 층화해서 분석했을 때, OSA의 심각도와 BMI 사이의 연관성은 없었다[16]. 외국의 다른 연구에서는 4년 가까이 비만대사수술을 시행하고 수면다원검사를 시행한 1,358명의 환자 중 813명(59.9%)에서 OSA가 확인되었으며, 이 중 405명(29.8%)은 AHI가 15/hr 이상으로 확인되었다. 미국수면학회 기준에 따라 분류했을 때, 경도 OSA는 408명(50.2%), 중등도 OSA는 192명(23.6%), 심한 OSA는 213명(26.2%)이었다[17]. 비만 수술 전 수면다원검사를 시행한 한 전향적 연구에서는 경도, 중등도, 고도 OSA로 분류된 환자가 각각 1명(2.3%), 7명(15.9%), 36명(81.8%)으로 확인되었다[18]. 이처럼 연구 결과에 따라 OSA의 심각도 차이가 나는 원인은 명확하지 않으나, 표본의 크기가 작아 결과의 뒤틀림이 있었을 가능성을 고려해야 하겠다. 또한 본 연구에서는 모든 비만대사수술 대상자에서 수면검사를 확인하지 않았으며 수면검사를 확인한 군에서만 분석하였기 때문에 OSA의 비율에서 차이가 나타났을 것으로 생각한다. 또한 STOP-Bang 설문조사를 시행하여 3점이 넘는 환자들을 대상으로 수면검사를 진행하였으므로 선택편향이 작용했을 가능성도 있다. 비만대사수술 환자에서는 중등도 이상의 OSA 비율이 높으므로, 수면검사를 통하여 동반하는 OSA를 진단하고 치료하는 것이 필요하겠다.
본 연구에서 비만대사수술 환자를 대상으로 수술 전 수면다원검사나 ApneaLinkTM를 시행한 환자를 분석하였다. 두 검사를 모두 시행한 16명의 환자들 중 검사 간 일치도는 높지 않았으나 대부분(87.5%)에서 중등도 이상의 OSA 환자를 동일하게 분류하였다. 국내의 한 연구에서 ApneaLinkTM와 수면다원검사를 측정하였을 때 무호흡 지수, 저호흡 지수, AHI의 값은 통계학적으로 유의미한 차이를 보이지 않았고, 민감도는 91%, 특이도는 73%로 확인되었다[19]. 외국의 연구에서도 수면다원검사와 ApneaLinkTM의 AHI를 비교했을 때 AHI≥15에서 가장 높은 민감도 91%, 특이도 95%가 확인되어[20] 본 연구와 일치하였다. 본 연구에서는 수면다원검사와 ApneaLinkTM 검사를 동시에 시행하지 않았기 때문에 일치도가 높지 않았을 수 있으나, 중등도 이상 OSA를 확인하는 목적으로는 ApneaLinkTM도 유용함을 유추할 수 있다.
중등도 이상 OSA가 동반된 군에서 당뇨병 유병률이 높았으며, 공복혈당도 더 높았다. 비만환자 중에서도 중등도 이상의 OSA가 있는 환자에서 대사적인 문제가 더 많음을 알 수 있다. 국내의 연구를 살펴보면 전국적인 인구 기반 데이터를 바탕으로 주요 교란 변수를 보정했을 때 대사증후군과 OSA 사이의 강한 연관성이 확인되었으며, TG 수치의 증가, 남자, 허리둘레의 증가가 OSA의 중요한 위험 인자로 확인된 바 있어[2] 본 연구 결과와 일치하였다. 중등도 이상 OSA 환자군에서 남성이 더 높은 경향성이 확인되었는데, 높은 포도당 농도와 당뇨 유병률은 남성의 비율이 더 높은 것과 연관이 있을 수도 있다. 비만수술을 시행 예정인 환자들에서 수면다원검사 또는 ApneaLinkTM를 통해 중등도 이상 OSA 동반 여부를 확인하는 것이 동반된 대사성질환 위험을 평가하는 데 도움될 것이다.
수술 전 OSA 동반 여부에 대한 평가는 수술 합병증을 낮추는 데도 도움이 된다. OSA는 수술 후 심장질환 및 호흡 부전의 중요한 위험 인자로 보고되었다[2,21]. 또한 단일 기관에서 시행된 3,000례의 수술을 분석하였을 때 OSA는 문합 누출의 양성 예측 인자로 보고되었다[22]. 비심장수술(non-cardiac surgery)을 시행한 289명의 OSA 환자와 189명의 대조군을 대상으로 한 코호트 연구에서도 OSA가 있는 경우 수술 후 저산소증, 전반적인 합병증, 중환자실 전동 비율이 더 많았고, 입원기간이 더 길었다[23]. OSA가 있는 경우 수술 후 합병증 발생 비율이 높고 입원 기간이 길어진다는 연구들을 고려한다면, 수술을 고려 중인 환자에서 OSA의 평가와 치료가 필요하며, 특히 OSA의 유병률이 높은 비만 환자에서는 정확한 평가가 필요하다고 할 수 있겠다.
본 연구는 후향적 단일기관 연구로 비만대사수술을 시행한 모든 환자에서 수면검사를 시행하지 않아 한계가 있다. 또한 OSA 유무를 평가하기 위해 수면다원검사와 ApneaLinkTM 검사를 각각 사용하였다. 비록 중등도 이상 OSA를 분류하는 것에는 일치도가 높았으나 급내상관계수가 낮았기 때문에 OSA를 정확하게 평가하지 못하였을 수 있다. 또한 일부 자료의 누락으로 대사증후군의 비율을 모두 평가하지 못하였다. 그리고 본 연구에서는 수술 이후 OSA와 비만 심각도의 변화를 장기적으로 추적하지 못하였으며 수술 후 합병증에 대한 조사도 이루어지지 않았다.
결론적으로 비만대사 수술 대상자 중 OSA의 동반 비율이 80.6%로 높았고, 중등도 이상 OSA 비율도 절반 이상이었다. 중등도 이상 OSA는 대사증후군이 동반되어 있을 가능성도 높아 수술 전 수면다원검사 또는 ApneaLinkTM를 이용해 중등도 이상 OSA 동반 유무를 평가하는 것이 필요하다.
Supplementary Materials
The online-only Data Supplement is available with this article at https://doi.org/10.13078/jsm.220008.
Notes
The authors have no potential conflicts of interest to disclose.
Author Contributions
Conceptualization: Seungmin Lee, Won Chul Shin. Data curation: Seungmin Lee, Jung-Ick Byun. Formal analysis: Seungmin Lee, Jung-Ick Byun. Investigation: Seungmin Lee, Jung-Ick Byun, Sung Il Choi. Supervision: Sung Il Choi, Won Chul Shin. Validation: Sung Il Choi. Writing—original draft: Seungmin Lee, Jung-Ick Byun. Writing—review & editing: Sung Il Choi, Won Chul Shin.
Funding Statement
None


