체인-스토크스 호흡이 신경계 중환자의 예후에 미치는 영향
Cheyne-Stokes Respiration and Prognosis in Neurocritical Patients
Article information
Trans Abstract
Objectives
Cheyne-Stokes respiration (CSR) is frequently found in critically ill patients and is associated with poor prognosis. However, CSR has not been evaluated in neurocritical patients. This study investigated the frequency and prognostic impact of CSR in neurocritical patients using biosignal big data obtained from intensive care units.
Methods
This study included all patients who received neurocritical care at the tertiary hospital from January 2018 to December 2019. Clinical information and biosignal data of intensive care units were used and analyzed. The respiratory curve was visually assessed to determine whether CSR and obstructive sleep apnea (OSA) were present, and a heart rate variability (HRV) was obtained from the electrocardiogram.
Results
CSR was confirmed in 166 of 406 patients (40.9%). Patients with CSR were older, had a higher frequency of cardiovascular risk factors as well as heart failure, and had a poor outcome (modified Rankin scale ≥4). As a result of multiple regression analysis adjusted for other variables, CSR was significantly associated with poor outcome with an odds ratio of 2.27 times higher (95% confidence interval 1.25–4.14, p=0.007). HRV analysis demonstrated that CSR and OSA had distinct autonomic characteristics.
Conclusions
This study first revealed the substantial frequency of CSR in neurocritical patients and suggests that it can be used as a predictor of poor prognosis in neurocritical care.
서 론
체인-스토크스 호흡(Cheyne-Stokes respiration, CSR)은 증가-감소 양상으로 과호흡과 무호흡/저호흡이 주기적으로 반복되는 호흡 양상을 말한다[1]. CSR은 중추성수면무호흡(central sleep apnea, CSA)의 가장 흔하고 대표적인 형태로, 기도가 물리적으로 막히는 폐쇄성수면무호흡(obstructive sleep apnea, OSA)과 달리 CSA는 수면 중 호흡 노력이 저하되거나 없어져 발생한다[2-4]. CSR은 뇌질환, 심장질환, 폐질환을 가진 환자에서 흔히 나타나며 특히 심한 심부전 환자의 약 60%에서 동반된다고 알려졌다[5]. CSR이 있을 경우 예후가 좋지 않다고 알려져 있는데, 최근 CSR 환자에서 적응형 서보 환기(adaptive servo ventilation) 치료가 예후 개선에 도움이 되지 않았다는 연구가 발표된 이후 결과 해석에 따른 논란이 많았다[6-9]. 가장 큰 쟁점은 CSR이 치료가 필요한 경우인지 또는 장기적인 생리적인 반응에 지나지 않는지에 대한 논쟁으로[10], 치료가 필요한 환자군에 대한 올바른 설정이 이와 같은 논란에 해답이 될 수 있겠다.
중환자실에 입원하는 환자에서 CSR에 대한 연구는 그리 많지 않고 다양한 빈도로 보고되었다. 급성 심혈관질환 중환자의 경우 한 연구에서는 약 34%에서 CSR이 확인되었던 반면, 다른 연구에서는 약 82%에서 CSR을 포함한 CSA가 발견되었다[11,12]. 심전도 신호를 이용하여 CSR 또는 주기적 호흡을 확인한 최근 연구에서는 전체 중환자의 약 84%에 이르는 높은 빈도가 확인되었고 중증도가 불량한 예후와 관계가 있음을 보였다[13]. 이러한 CSR 빈도는 환자군과 연구한 호흡 양상 및 연구 방법의 차이에 기인한 것으로 판단된다. 신경계 질환 중에서는 뇌졸중에서 CSR의 빈도가 약 20~40%를 차지한다는 것이 보고되었으며, 뇌전증에서는 돌연사(sudden unexplained death in epilepsy)와 관련성이 보고되었다[14-16]. 하지만 중환자실에 입실하는 신경계 질환 환자에서 CSR의 빈도나 예후와의 연관성은 지금까지 연구된 바 없다.
본 연구에서는 중환자실 치료를 받은 신경계 질환 환자를 대상으로 호흡 양상을 확인하기 위해 중환자실 생체신호 빅데이터를 이용하였다. 그 결과 신경계 중환자 전체에서 CSR의 빈도를 확인하였고 임상 지표와 함께 예후와의 연관성을 분석하였다. 추가적으로 CSR과 예후와의 관계에 대한 설명을 위해 CSR이 자율신경계에 미치는 영향을 심박변이지수(heart rate variability, HRV)로 알아보았다.
방 법
본 연구는 2018년 1월부터 2019년 12월까지 아주대학교병원 신경과에 입원하여 중환자실 치료를 받은 모든 환자를 대상으로 하였다. 아주대학교병원은 2017년부터 중환자실 생체신호를 전향적으로 수집하고 있다. 이 연구 과정과 중환자실 생체신호 수집은 각각 아주대학교병원 윤리심의위원회의 승인을 받았다(IRB no. AJIRB-MED-MDB-20-136; no. AJIRB-MED-MDB-16-155).
환자 선정 기준으로는 1) 18세 이상의 성인 남녀, 2) 입원 3일 이내 중환자실에 입실한 초기 중증 환자, 3) 22시부터 다음 날 6시까지의 자가 호흡 데이터가 최소 하루 이상 가능한 환자로 정했다. 신경과 입원 환자들은 신경계 중환자실, 응급 중환자실, 내과계 중환자실, 또는 외과계 중환자실에 입원한 경우를 모두 포함하였다. 신경과에 입원하여 3일 이내 중환자실에 입실한 초기 중증 성인 환자는 총 495명이었고 그중 89명은 하루 이상의 자가 호흡 데이터가 없어 제외되어 총 406명의 환자에 대해 분석을 시행하였다. 환자의 임상 정보로 인구학적 정보, 기저 질환, 진단, 중환자실 입실 시 acute physiology and chronic health evaluation-II(APACHE-II) 점수, 기관 삽관 유무, 기관 절개술 유무, 입원 기간, 중환자실 체류 기간 및 퇴원 시 수정 랭킨 점수(modified Rankin scale, mRS)를 후향적으로 수집했다. 기저 질환은 고혈압, 당뇨, 심혈관질환, 심방세동, 폐질환(결핵, 간질성 폐질환, 만성 폐색성 폐질환), 뇌졸중, 신경퇴행성질환(파킨슨, 치매)을 포함했다. 진단은 다음과 같이 5개로 분류하였다: 뇌혈관질환(neurovascular disease), 감염/염증질환(infection/inflammation), 경련성질환(seizure), 척수/신경/근육질환(cord/nerve/muscle), 대사성/독성/종양질환(metabolic/toxic/neoplasm). 연구에 포함된 대상자들 중 수면다원검사를 시행한 환자의 검사 결과를 확인하였고 본 연구에서 판단한 호흡과 비교하였다. 입원 중 경흉부심초음파를 시행한 환자들에서는 좌심실박출계수(left ventricular ejection fraction, LVEF)를 수집하였고, LVEF가 45% 이하인 환자들은 심부전으로 판단하였다. mRS가 4점 이상인 경우 불량한 예후로 정의하였다.
중환자실 생체신호 빅데이터는 아주대학교의료원 의료정보학과에서 기획득한 자료를 사용했다[17]. 가용한 생체신호는 호흡, 심전도, 맥파(photoplethysmography), 혈압을 포함하며, 생체신호의 변동을 수치화한 자료로, 본 연구에서는 호흡과 심전도 데이터를 분석했다. 데이터는 중환자실의 BSM-1753(Nihon Kohden, Tokyo, Japan) 또는 IntelliVue MP70 (Philips Medical Systems, Andover, MA, USA) 모니터 장비로부터 얻어졌고 표본 추출률(sampling rate) 125 Hz로 저장된 수치를 분석에 이용하였다. 호흡 데이터는 흉곽의 심전도 전극에서 얻어진 임피던스를 이용해 각 장비에서 이차적으로 얻어진 신호로 일반적으로 중환자실 감시에 사용하는 신호다. 호흡 신호를 10분 간격으로 시각화한 후 임상 정보가 가려진 조건에서 신경과 전문의가 수면호흡장애 여부를 판단하였다. CSR은 미국수면학회의 진단기준(American Academy of Sleep Medicine criteria, version 2.6)의 기준을 이용하였으며 본 연구에 맞게 일부 변형하여 다음과 같이 정의했다[18].
A. 호흡 곡선에서 판단되는 과호흡과 무호흡/저호흡이 반복되어 나타나며 증가-감소(crescendo and decrescendo) 양상으로 변화하고 각 사이클의 길이는 40초 이상임.
B. 분석된 날의 22시부터 다음 날 6시까지 1시간당 5회 이상의 증가-감소 호흡 양상이 나타남.
분석된 날은 중환자실 입원 중 10일 이내로 자가 호흡 데이터가 가능한 날로 정하였다. OSA 또한 흉곽 호흡 신호를 이용해 판단하였다. 심전도 유래 호흡(electrocardiogram-derived respiration)을 이용해 높은 정확도로 OSA를 판단한 기존 연구들이 있었으며, 호흡 모양이 여러 변수 중 높은 정확도를 보임을 확인한 바 있다[19,20]. 본 연구에서는 CSR이 아닌 호흡 신호의 변화 중, 호흡 진폭의 단속적인 저하가 나타나며, 그 시각적 양상이 일반적인 수면다원검사에서 전형적으로 보이는 폐쇄성무호흡 또는 폐쇄성저호흡으로 판단되고, 분석된 날의 22시부터 다음 날 6시까지 1시간당 5회 이상 나타날 때 OSA로 판단하였다[21]. 대표적인 CSR과 OSA의 호흡 양상은 그림과 같다(Fig. 1). 호흡 데이터는 Python version 3.8(Python Software Foundation, Beaverton, OR, USA)을 이용하여 시각화하였다.

(A–C) Characteristic respiratory signal of Cheyne-Stokes respiration obtained from a 72-year-old female, a 79-year-old female, and an 89-year-old male. (D–F) Characteristic respiratory signal of obstructive sleep apnea obtained from a 53-year-old male, a 77-year-old female, and a 65-year-old male. All the patients had an ischemic stroke.
심전도 데이터로부터 HRV를 구하였다. HRV는 1) CSR만 있는 환자, 2) OSA만 있는 환자, 3) CSR과 OSA가 모두 없는 환자를 나이 및 성별로 일치하여 각 23명에 대해 데이터를 분석하였다. 심방세동 또는 심부전이 있는 환자는 포함되지 않았다. HRV를 비교 분석하는 과정은 다음과 같이 Szollosi 등의 연구 방법을 이용하였다[22]. CSR과 OSA 환자에서는 안정호흡, CSR, OSA 조건에 대해, 모두 없는 환자에서는 정상 호흡에 대해 HRV를 분석할 구간을 선택하였는데, 22시부터 다음 날 6시 내에서 잡음(artifact)이 최소인 10분을 각각 택하였다. 안정호흡 또는 정상호흡은 10분 동안 호흡 중 호흡 곡선의 진폭이 5% 이내로 변동이 거의 없는 부분을 택했으며 세 군에서 모두 선택했고, CSR과 OSA의 안정호흡은 합쳐서 분석했다. Kubios HRV Standard version 3.3.1(Kubios Oy, Kuopio, Finland)을 이용하여 HRV의 시간 영역 및 주파수 영역 변수들을 구했다. 시간 영역 변수들은 심전도에서 인접한 QRS 복합체의 R과 연속된 다음 R 사이의 간격을 뜻하는 NN 간격(ms), 60,000/NN 간격으로 계산되는 heart rate (/min), NN 간격의 표준편차인 standard deviation of NN interval, 인접한 NN 간격의 차이에 대한 제곱의 합을 평균하여 제곱근을 구한 root mean square of the successive differences(RMSSD), 연속적인 NN 간격의 차이가 50 ms를 초과하는 NN 간격의 개수를 백분율로 나타낸 proportion of successive RR intervals(pNN50)를 포함했다[23]. 주파수 영역 중 very low frequency(VLF) 대역은 0.00~0.04 Hz, low frequency(LF) 대역은 0.04~0.15 Hz, high frequency(HF) 대역은 0.15~0.40 Hz에서 분석을 시행하였다. 각 대역 주파수 파워(ms2)를 자연 로그로 변환하여 수치를 표시하거나, 전체 주파수 파워에 대한 백분율을 구하였다. 또한 LF 파워 대비 HF 파워 비율(LF/HF)을 구하였다.
CSR 유무에 따라 임상 지표를 통계적으로 비교하였다. 연속형 변수는 평균과 표준편차로, 범주형 변수는 수와 백분율로 표시하였다. 연속변수는 Student’s t-test를 이용했고 범주형 변수는 Chi-square test나 Fisher test를 이용했다. CSR이 환자의 퇴원 시 예후에 미치는 영향은 다중회귀분석(multiple binary logistic regression)으로 분석하였다. 단변량분석(univariate analysis)에서 불량한 예후와 관련 있었던(p<0.1) 요인들을 다중회귀분석의 독립변수들로 투여하였고, 독립변수들 간에는 다중공선성이 없음을 확인하였다. 통계 분석은 SPSS statistics version 25.0(IBM Corp., Armonk, NY, USA)를 사용하였다.
결 과
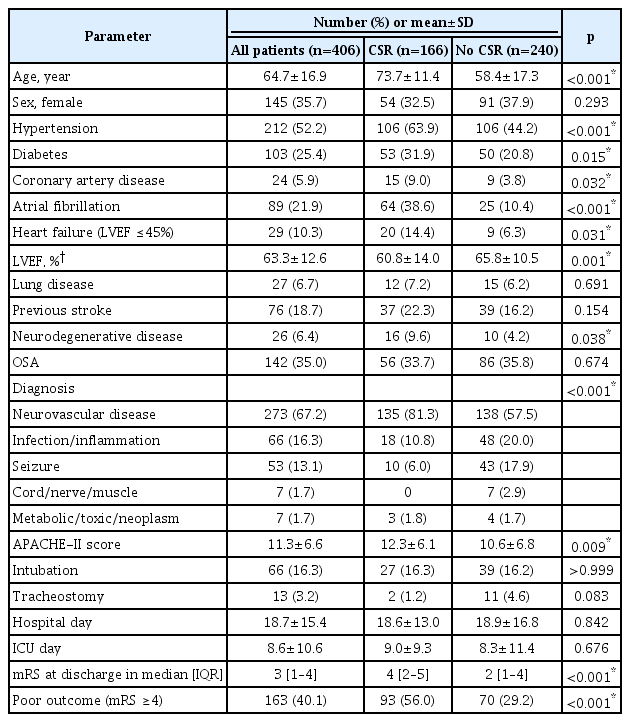
전체 406명 중 CSR이 있었던 환자는 166명으로 40.9%였다. 모든 환자 및 CSR 여부에 따른 환자군의 임상 정보를 Table 1에 요약하였다. CSR군은 CSR이 없던 군에 비해 나이가 많았으며(73.7±11.4세 vs. 58.4±17.3세, p<0.001), 성별은 통계적인 차이가 없었다(여성, 32.5% vs. 37.9%, p=0.293). CSR군에서 고혈압, 당뇨, 심혈관질환, 심방세동, 신경퇴행성 질환의 빈도가 높았으나 폐질환, 뇌졸중 병력은 유의한 차이가 없었다. LVEF는 CSR군에서 유의하게 낮았으며, LVEF가 45% 이하인 심부전 환자도 많았다(14.4% vs. 6.3%, p=0.031). OSA는 전체 환자 중 35.0%에서 확인되었으며, CSR군과 CSR이 없던 군에서 OSA의 빈도는 통계적인 차이가 없었다. 입원 목적 진단 중 뇌혈관질환의 빈도(67.2%)가 가장 높았으며 CSR군에서 뇌혈관질환의 빈도(81.3%)가 더 높았다. APACHE-II 점수는 CSR군이 더 높았으나, 기관 삽관 유무, 기관 절개술 유무, 입원 기간, 중환자실 체류 기간은 두 군 간에 유의한 차이가 없었다. mRS는 CSR군에서 유의하게 높았으며, mRS 4 이상인 불량한 예후도 유의하게 많았다(56.0% vs. 29.2%, p<0.001).
전체 대상자 중 2명이 수면다원검사를 시행하였다. 그중한 명은 뇌전증중첩증 진단하에 입원한 75세 남환으로 17일간 중환자실에서 치료받았고, 중환자실에서 일반병실로 전실한 당일 수면다원검사를 시행한 후 CSR이 있는 CSA를 진단하였던 환자였다. 다른 한 명은 좌측 중대뇌동맥 영역 뇌경색을 진단받은 42세 남환으로 2일간 중환자실 치료를 받았으며, 일반병실로 전실한 다음날 수면다원검사를 시행하여 severe OSA를 진단했던 환자였다. 두 환자의 호흡 곡선과 수면다원검사 중 대표적인 부분을 Fig. 2에 표시하였다.
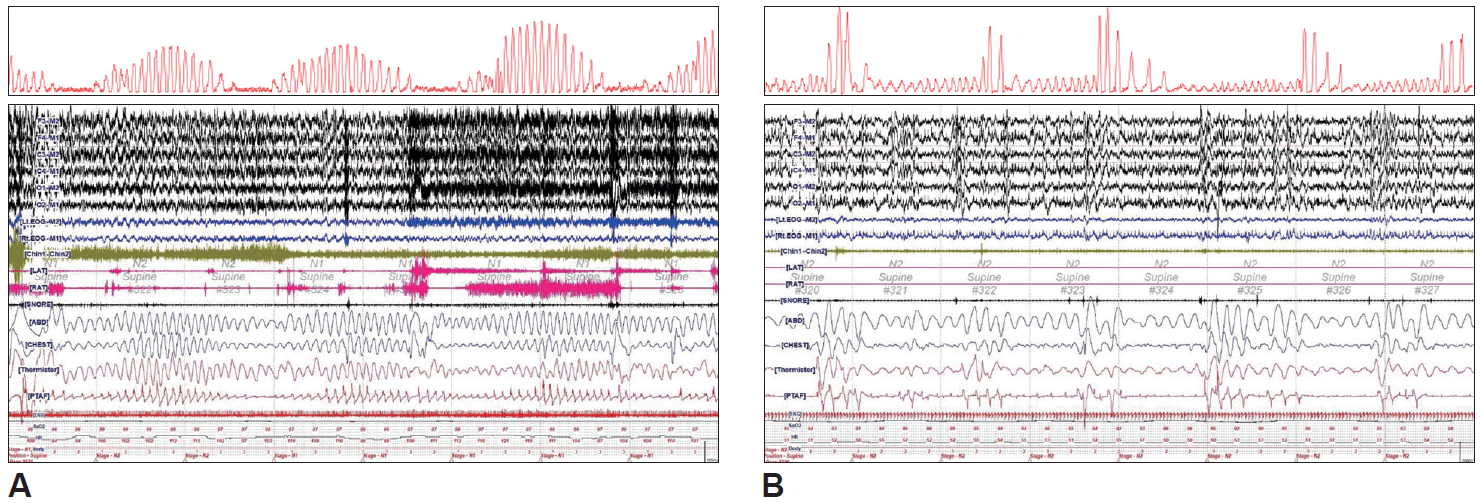
(A) A 75-year-old male with a status epilepticus and Cheyne-Stokes respiration in an intensive care unit. (B) A 42-year-old male with an ischemic stroke and obstructive sleep apnea in an intensive care unit. They underwent a polysomnography afterwards and characteristic figures of respiratory signal and polysomnographic data for four minutes are presented, respectively.
진단에 따라 CSR이 예후에 미치는 영향이 다른지 확인하기 위해 각 진단 분류별 예후를 확인해 보았다(Table 2). 뇌혈관질환에서 CSR이 있는 경우는 없는 경우에 비해 불량한 예후가 유의하게 높은 빈도로 확인되었다(58.5% vs. 32.6%, p<0.001). 뇌혈관질환 외의 경우에도 CSR은 예후의 안 좋은 인자로 확인되었다(45.2% vs. 24.5%, p=0.041). 감염/염증질환에서는 통계적 유의성이 확인되었지만 그 외의 질환 분류들에서는 적은 환자 수로 인해 통계적인 비교가 어려웠다.
불량한 예후에 영향을 미치는 임상 요인을 확인하기 위해 각 변수들에 대해 단변량분석을 시행했으며, p 값이 0.10 이하인 독립변수들을 다중회귀분석에 투입하였다(Table 3). 그 결과 CSR[odds ratio(OR)=2.27(1.25-4.14), p=0.007]과 여성[OR=2.42(1.40-4.21), p=0.002]이 다른 변수들을 보정했을 때에도 불량한 예후와 유의한 관계가 있는 변수였다. 심부전 대신 LVEF를 독립변수로 사용하거나, 심부전과 LVEF 변수 없이 분석을 시행해도 같은 유의한 결과를 보였다.
CSR이 자율신경계에 미치는 영향을 조사하기 위해 CSR과 OSA 각 23명, 그리고 CSR이나 OSA가 모두 없는 23명의 환자에서 성별, 나이를 일치하여 HRV를 분석하였다(Table 4). CSR 또는 OSA의 안정호흡에서 HRV 변수는 유의한 차이가 없었고, 정상호흡과도 통계적인 차이가 없었다. 안정호흡 또는 정상호흡을 기준치로 정하여 CSR과 OSA를 각각, 그리고 서로 비교하였다. CSR은 OSA에 비해 RMSSD와 pNN50 값이 유의하게 컸으며 안정호흡은 두 군의 중간에 해당하는 값을 보였다. CSR에서 전반적으로 주파수 파워가 저주파 대역에서 절대값이 커졌는데, CSR보다 OSA가 극저주파수 대역의 비율이 커지는 경향을 보였다. LF/HF는 CSR과 OSA가 모두 안정호흡에 비해 컸으나 둘 사이의 통계적인 차이는 없었다.
고 찰
본 연구는 중환자실에 입원한 신경계 질환 환자를 대상으로 CSR을 최초로 확인했다. 가능한 모든 환자에 대해 분석하기 위해 중환자실의 생체신호 감시장치에서 얻은 빅데이터를 이용했다는 장점이 있다. 그 결과 신경계 중환자에서 CSR의 빈도가 약 41% 정도로 높으며 불량한 예후와 승산비 약 2.3의 유의한 관계가 있음을 보였다.
본 연구 결과인 약 41%의 CSR의 빈도는 Richards 등의 심혈관질환 중환자를 대상으로 한 연구에서 확인한 34%와 유사하다[11]. 본 연구에 포함된 신경계 전체 중환자 중 약 2/3 정도의 환자가 뇌혈관질환 중환자로 심혈관질환 중환자와 위험인자들을 공유하기 때문에 유사한 결과를 보였다고 판단된다. Richards 등의 연구는 수면다원검사를 하룻밤 동안 시행하여 CSR의 여부를 확인하였는데[11], 무호흡/저호흡을 모두 CSR로 판단한 본 연구와 달리 무호흡이 있는 경우만 CSR로 판단하였다는 차이점이 있다. Van den Broecke 등의 연구와 Tinoco 등의 연구에서는 각각 심혈관질환 중환자와 일반적인 중환자를 대상으로 수면다원검사 및 심전도 신호로 부터 CSR 및 주기적 호흡 여부를 확인하였고 모두 80% 이상의 높은 빈도를 보였다[12,13]. 연구에서 사용된 CSR의 정의가 상대적으로 단순하며 CSR의 횟수에 대한 고려가 없었다는 것이 본 연구에 비해 높은 CSR 빈도를 보인 원인으로 판단된다.
이와 같이 CSR의 유병률은 조사 집단과 방법에 따라 큰 차이를 보인다. 일반 인구에서 CSR의 유병률은 0.4% 정도로, OSA의 0.9%보다 낮은 편이다[24]. 메타 분석 결과 뇌졸중과 일과성허혈발작 환자에서는 CSA 또는 CSR의 빈도가 약 7% 정도로 확인되었다[25]. 최근 급성 뇌경색 환자에서 시행한 국내 두 연구에서는 모두 19%의 CSR 빈도를 보였다[15,26]. 본 연구에서 뇌혈관질환 환자를 따로 떼어 CSR의 빈도를 분석하면 약 49%(135/273)로 확인되며 이는 기존 연구들에 비해 다소 높은 편이다. 이러한 빈도의 차이는 중환자실 치료를 필요로 하는 뇌혈관질환의 경우 CSR을 일으킬 정도로 광범위한 뇌병변을 일으켰을 가능성이 높기 때문일 것이며, 그와 함께 CSR의 원인이 되는 혈역학 변화를 초래하는 여러 집중 치료와 합병증이 원인으로 판단된다[3,4].
본 연구에서 인구학적인 정보와 기저 질환을 보정했을 때 CSR이 있는 신경계 중환자는 그렇지 않은 환자에 비해 불량한 예후가 발생할 가능성이 약 2.3배 높았다. CSR은 심부전 환자에서 예후와 관련성이 잘 알려져 있다[27,28]. 신경계 질환 중 뇌졸중에서 CSR의 예후에 대해서는 몇몇 연구가 있었다. Rowat 등은 138명의 뇌졸중 환자에서 증상의 중증도를 포함한 변수를 보정했을 때 CSR이 3개월째 예후(mRS≥3)와 관계가 있음을 다중회귀분석으로 보인 바 있다[29]. 하지만 Siccoli 등은 74명의 뇌경색 환자를 대상으로 한 연구에서 CSR의 정도와 퇴원 시 mRS 사이에 통계적인 유의성을 발견하지 못하였고, 그 원인은 환자 수와 추적 기간의 차이로 해석하였다[14]. 또한 국내 뇌경색 환자 연구에서 CSR은 변수 보정 이후 예후와의 관계가 유의하지 않았는데, 이는 CSR이 뇌졸중의 결과로 작용했거나, 처음부터 심한 뇌졸중에 동반되었기 때문일 수 있을 것으로 해석하였다[26]. 이러한 과거 연구들과 비교했을 때 본 연구에서는 뇌혈관질환을 다수 포함한 신경계 중환자의 예후와 CSR과의 통계적 유의성이 다른 변수들 보정 이후에도 분명했는데, 중환자실 치료를 요하는 중증 환자에서는 CSR이 증상의 악화 요인으로 작용했을 것으로 판단할 수 있다. 중환자실 치료 중 환자의 악화 요인은 심혈관계를 포함한 혈역학적 상태와 함께 자율신경계 기능이 중요하고[30,31], 이러한 점이 과거 연구와 일부 다른 결과를 보인 차이점으로 판단된다. 뇌졸중 이외의 신경계 질환에서는 CSR과 예후와의 관계가 잘 알려져 있지 않은데, 본 연구 결과 뇌혈관질환 외의 진단에 대해서도 CSR이 예후와 관계 있었으며, 이에 대해 더 많은 수의 환자군 연구가 필요하겠다. 본 연구에서는 또한 여성이 불량한 예후와 관련이 있었다. 남성과 여성의 임상 정보는 여성의 평균 연령이 높다는 점 이외에 기저 질환에 큰 차이가 없어, 젊은 남성과 고령인 여성의 예후의 차이가 반영된 결과로 판단된다.
HRV 분석에서 CSR은 OSA와 구분되는 변수 특성을 보였다. 시간 영역 변수인 RMSSD와 pNN50은 안정호흡에 비해 CSR은 증가했고 OSA는 감소했는데, 이는 CSR에서 부교감신경 활성도가 커지고 OSA는 반대임을 뜻한다. 통계적으로는 유의하지 않았으나 CSR에서 NN 간격이 커지고 NN 간격의 표준편차는 증가하는 경향을 보였는데 이는 느린 맥박과 함께 심박 변동이 불규칙했다는 것을 의미한다. CSR과 OSA에서 HRV의 시간 영역 변수들의 변화는 과거 연구와 다른 결과를 보였는데, 기존 연구는 본 연구와 달리 심부전 환자만 대상으로 했다는 차이 때문으로 판단된다[22]. 주파수 영역 분석에서는 부교감신경 조절을 반영하는 HF 대역 파워가 안정호흡에 비해 둘 모두 감소하였는데 OSA에서 더 감소폭이 컸다. VLF 대역의 증가는 CSR이나 OSA의 호흡 진동으로부터 영향 받는 것으로 알려졌다[22,32]. 교감신경과 부교감신경을 모두 반영하는 LF는 CSR에서 더 증가했으나 통계적으로 유의하지는 않았으며, 교감신경 활성도로 해석되는 LF/HF는 둘 모두 유의하게 증가했고 CSR의 변화가 더 컸다. 기존 연구들에서도 같은 경향의 주파수 영역 변화를 보인 바 있다[33,34]. 종합하면 CSR은 부교감신경과 교감신경이 모두 활성화되는 결과로 해석할 수 있겠으며 OSA는 교감신경이 주로 활성화되는 것으로 판단할 수 있겠다. 이와 같은 HRV의 변화는 혈역학적 변화와 연관되며 심부전 환자에서는 불량한 예후와 관계가 높음이 알려졌다[35,36].
본 연구는 몇 가지 제한점이 있다. 첫 번째로는 신경계 질환의 중증도가 고려되지 않았다는 점이다. 특히 환자의 다수를 차지하는 뇌졸중의 정도나 뇌병변 범위에 대한 고려가 없었으며, 향후 연구에서는 질환별 중증도에 대한 고려가 필요하겠다. 두 번째로는 호흡 신호의 획득과 시각적 해석에 대한 본질적인 한계점이다. 심전도 전극에서 얻어진 임피던스를 통한 흉곽 호흡 신호만 이용했기 때문에 표준의 수면다원검사에 비해 정확도가 떨어질 것이며, 두 검사 방법에 대한 검증 연구가 없었다는 한계가 있다. 호흡 곡선 혹은 심전도 유래 호흡을 이용한 CSR 또는 OSA를 판단하는 방법에 대해 몇몇 연구가 있으나[13,19,20,37], 임상에서 검증은 아직 부족한 것이 사실이다. 이러한 한계점은 호흡 곡선이 판단 기준에 가장 중요한 CSR에 비해, 구강 호흡 신호와 산소포화도가 중요한 OSA에서 더 크게 작용했을 것으로 판단된다. 또한 CSR에 대한 정량화에 어려움이 있어 정량적 무호흡/저호흡 수치와 비교도 이루어지지 않았다. 이와 함께 수면 단계에 대한 고려도 현재 중환자 생체신호 데이터만으로는 어렵다는 단점이 있다. 마지막 제한점은 호흡에 영향을 미치는 약물에 대해 고려하지 못하였다는 점이다. 중환자실에서 주로 투여되는 베타 차단제 등의 심혈관계 약물 및 진정제 등의 신경계 약물이 환자의 호흡에 영향을 주었을 가능성이 있으며 이에 대해서는 추가 분석이 필요하겠다.
이와 같은 한계점에도 불구하고 본 연구는 신경계 중환자에서 CSR의 빈도를 최초로 확인했고 불량한 예후의 예측인자로 활용될 수 있음을 보였다. 임상에서 CSR을 중환자 생체신호 데이터를 통해 빠르게 확인하고 필요 시 교정하는 것이 예후에 도움이 될지 향후 연구가 필요하겠다.
Acknowledgements
This study was supported by the Research Grant of Korean Sleep Research Society in 2019.
Notes
The authors have no potential conflicts of interest to disclose.
Author Contributions
Conceptualization: Tae-Joon Kim. Data curation: Tae-Joon Kim, Jung Hwan Kim, Jong-Hwan Jang. Formal analysis: Tae-Joon Kim. Investigation: Tae-Joon Kim, Dukyong Yoon. Supervision: Tae-Joon Kim. Writing—original draft: Tae-Joon Kim. Writing—review & editing: Tae-Joon Kim, Dukyong Yoon.