AbstractObjectivesNarcolepsy diagnosis is often complicated, using relatively simple criteria that rely on sleep onset rapid eye movement periods (SOREMP) and average sleep latency in the multiple sleep latency test (MSLT). Therefore, the main goal of this study was to gain a new perspective on narcolepsy diagnosis and explore the role of rapid eye movement (REM) dysregulation by examining the progression of sleep stage transitions leading to SOREMP.
MethodsFrom 2008 to 2022, 109 patients diagnosed with narcolepsy who underwent polysomnography and MSLT were included. Comprehensive data on clinical features, polysomnography, and MSLT findings were collected. For the MSLT, we not only considered SOREMP and mean sleep latency but also the sleep stage transition preceding SOREMP, the presence of N3, and the average SOREMP duration.
ResultsAmong the 109 patients enrolled in the study, 59 were diagnosed with narcolepsy type 1 (NT1) and 50 with narcolepsy type 2 (NT2). We observed a high frequency of transitions in the MSLT of waking to REM (W-R) in patients with NT1. Moreover, the occurrence of W-R was associated with a higher number of SOREMPs. The temporal distribution of the MSLT results revealed a significant correlation; W-R occurrences were more frequent during the third nap.
서 론기면병은 과도한 주간 졸음, 탈력발작 및 비정상적인 rapid eye movement (REM) 수면 패턴을 특징으로 하며 1형 기면병(narcolepsy type 1, NT1)과 2형 기면병(narcolepsy type 2, NT2)의 두 가지 하위 유형으로 나뉘고 각각 뚜렷한 임상적 및 병리생리학적 특징을 나타낸다[1,2].
NT1의 병태생리학의 핵심은 hypocretin 결핍이다. 시상 하부에서 생성되는 hypocretin은 각성을 촉진하고 수면-각성 주기를 조절하는 데 중요한 역할을 한다. NT1에서는 이러한 hypocretin 세포 파괴로 인해 뇌척수액 hypocretin 수치가 현저하게 감소하게 되는데, 이와는 대조적으로 NT2는 일반적으로 정상 또는 거의 정상에 가까운 뇌척수액 hypocretin 수치를 가지며, 이러한 hypocretin 농도는 두 아형 사이의 주요한 차이점을 나타낸다[3,4].
다중 수면 잠복기검사는(multiple sleep latency test, MSLT) 기면병의 중요한 진단 도구이다. 현재 진단기준에는 평균 수면 잠복기와 수면 개시 렘수면(sleep onset REM periods, SOREMP)을 측정하여 판단을 내리게 되는데 NT1에서는 NT2에 비하여 평균 수면 잠복기가 짧고 SOREMP가 더 자주 발생하는 경향을 보여 주간 졸음 수준이 높아짐을 나타낸다[5].
수면발작(sleep attack)과 주간과다졸림의 공통점을 가지고 있는 NT1과 NT2이지만, 위의 뇌척수액 hypocretin과 MSLT의 결과는 두 기면병 아형의 REM 경향성에서 차이가 있음을 시사한다. 그러나 우리나라 환경에서 뇌척수액 hypocretin 측정이 제한적이며, 현재의 기면병 진단기준에는 SOREMP 횟수 및 평균 수면 잠복기만으로 진단을 하기 때문에 MSLT에 대해 보다 심층적인 이해가 필요하다.
일반적으로 정상적인 각성-수면 이행(wake to sleep transition) 은 N1, N2를 거쳐 때때로 N3을 이후 R로 진행하게 되는 순차적인 양상을 보인다[6]. 수면 단계 전환에 대한 몇몇 연구에서 보고한 바로는 각성 또는 N1단계에서 REM으로의 진행은 특발성 과수면증이나 수면시간 부족에 의해 발생되는 과다수면증에 비해 기면병에서 높다고 하였다. 또한 NT1에서는 N1에서 REM으로 진행하는 것이 75%, NT2에서는 52%로 기면병 아형에서도 차이를 보였다[7,8]. 이 결과들은 REM 수면의 조절장애가 기면병의 핵심이라는 점을 의미한다.
수면 단계 전환에 대한 이전 연구들은 N2에서 REM으로의 전환을 정상으로 간주하고 N1과 각성에서 REM으로 전환을 바탕으로 진행되었다. 그러나 우리는 REM으로의 수면 단계 전환에서 각성 상태와 N1 사이에 아직 알려지지 않은 차이가 있을 수 있다고 생각하였다. 따라서 본 연구는 각성 상태에서 REM 상태로의 전환에 초점을 두어 NT1과 NT2 사이의 수면 단계 전환 특성을 규명하며 또한 이러한 불안정성이 주간 시간대별로 차이가 있는지도 확인하고자 한다.
방 법연구 대상 및 평가 방법2008년 1월부터 2022년 12월 기간 동안 주간과다졸림으로 내원하여 수면다원검사와 다중수면 잠복기 검사를 시행하고 NT1과 NT2로 진단받은 109명이 연구에 포함되어 의무기록을 바탕으로 후향적으로 진행되었다. 주간과다졸림을 유발할 수 있는 수면무호흡증, 일주기리듬수면-각성장애 및 특발성 과다수면증 뿐만 아니라 다중 수면 잠복기검사에서 SOREMP 2회 이상, 평균 수면 잠복기가 8분 이내에 해당되더라도 약물 요인, 평소 수면 패턴 등을 고려하여 과수면증 유발 요인이 있는 경우는 제외되었다. 기면병의 진단기준은 국제수면장애분류 3판(International Classification of Sleep Disorders-3, ICSD-3)을 바탕으로 이루어졌으며 다중 수면 잠복기가 기면병에 합당하고 뚜렷한 탈력발작이 동반되어 있는 경우에는 NT1, 그렇지 않은 경우에는 NT2로 진단하였다[9]. 본 연구에 사용된 연구 기준, 방법 및 평가는 삼성서울병원 기관윤리위원회의 심의(승인번호 2023-07-114)와 동의 면제 승인을 획득하였으며, 기관윤리심의위원회의 관리 감독하에 시행되었다.
설문지를 통해 성별, 연령 등의 인구학적 특성을 확인하였다. 임상양상은 Epworth sleepiness scale (ESS)이 10점 이상인 경우 주간과다졸림이 동반된 것으로 판단하였으며 insomnia severity index (ISI) 및 Pittsburgh Sleep Quality Index (PSQI)로 불면증과 전반적인 수면의 질을 평가하였다.
다중 수면 잠복기검사에 앞서 2주간 수면에 영향을 미칠 수 있는 약물을 중단하였으며 수면일기 작성을 통해 수면박탈과 같은 과수면증 유발요인을 확인하였다. MSLT 전날에 야간 수면다원검사를 시행하였으며 MSLT는 다음 날 아침 기상 2시간부터 시작하여 2시간 간격으로 5회의 낮잠으로 시행하였다. 수면 잠복기(sleep latency)는 불을 끈 시간부터 환자가 잠을 들기 시작한 첫 번째 에포크(epoch)까지의 시간으로 정의하였고, 평균 수면 잠복기(mean sleep latency)는 5회의 낮잠에서 수면 잠복기 평균을 계산하여 나온 값으로 확인하였다. SOREMP는 잠들기 시작한 후 15분 이내에 나타나는 렘 수면으로 정의하였다. 야간 수면다원검사(overnight polysomnography)는 Embla N7000 (Medcare Flaga, Reykjavik, Iceland)를 사용하였다. 뇌파(C3-A2, C4-A1, F3-A2, F4-A1, O1-A2, O2-A1), 4채널 안전위도(electro-oculography) 및 턱 근전도로 수면 단계와 각성을 판정하였으며 흉곽과 복부벨트를 이용하여 호흡운동을 측정하였다. 호흡량은 온도감지센서와 압력센서로 측정하였으며 심전도, 양측 전경골근(anterior tibialis)에 부착한 2채널의 근전도, 맥박산소측정(pulse oximetry)을 측정하였다.
각 환자는 최소 1회 다중 수면 잠복기검사를 받았으며, 일부 환자는 최대 3회까지 검사를 반복하였다. 여러 차례 걸쳐 시행된 검사의 경우, 단일 결과만을 분석에 활용하면 선택 편향이 발생할 수 있으므로, 모든 반복 검사 결과를 포함하여 분석을 진행하였다. 또한, 각 검사 시에도 앞서 서술한 검사 전 전처치 과정을 동일하게 준수하였다.
추가적으로 MSLT에서 각 낮잠마다 REM으로의 수면 단계 전환 과정도 분석에 포함되었다. 수면 단계 전환은 5회의 낮잠 중에서 SOREMP이 있는 낮잠 시기에 hypnogram에서 기록된 지표를 바탕으로 분류하였으며 REM 전환까지 여러 단계를 걸치더라도 REM 직전 단계를 수면 단계 전환의 기준으로 정하였다. 이를 바탕으로 각성에서 REM (waking to REM, W-R), N1에서 REM (non-REM stage 1 [NREM1] to REM, N1-R), N2에서 REM (non-REM stage 2 [NREM2] to REM, N2-R) 세 가지로 분류하였다.
통계 방법연속형으로 측정된 변수는 평균과 분산으로 기술하였으며 통계적 유의성은 독립t검정으로 확인하였다. 범주형 변수는 빈도(n)와 비율(%)로 기술하였으며 카이제곱검정 결과로 유의성 판단하였다. 그리고 분석에 포함된 자료는 한 환자당 최소 1회부터 3회까지 MSLT를 반복 시행한 정보가 포함되어 있으며 MSLT 검사상 낮잠을 5회 반복하는 다계층적인 특성을 지니고 있어 혼합효과모형(mixed effect model)을 적용하여 NT1과 NT2의 MSLT 지표를 비교하였다. 통계 분석은 R version 4.3.1 (R Core Team, R Foundation for Statistical Computing, Vienna, Austria)를 이용하였다.
결 과대상자들의 임상양상 및 수면검사연구에 포함된 환자는 총 109명이었으며 NT1이 59명 NT2가 50명이었다. 평균연령과 성별은 차이가 없었다(Table 1). 임상적으로 주간 졸림의 차이는 없었으나(ESS, 15.8±5.0 vs. 14.2±5.5, p=0.28) NT1에서 유의하게 불면증이 심했으며(ISI, 13.5±6.9 vs. 8.1±4.7, p=0.003) 전반적인 수면의 질 저하도 관찰되었다(PSQI, 8.4±3.2 vs. 6.3±2.4, p=0.01). 가장 처음 진단 과정에서 참고된 야간 수면다원검사와 MSLT 결과에서는 야간 수면다원검사에서는 총 수면시간은 차이가 없었으나 수면 잠복기는 유의하게 NT1에서 짧았으며(sleep latency [min], 4.0±5.0 vs. 7.1±7.9, p=0.02) 수면 구조는 NT1에서 N1의 비율이 높았고(N1/total sleep time (TST) [%], 24.0±14.4 vs. 14.6±11.6, p=0.001) N2는 NT2에서 높았다(N2/TST [%], 45.1±10.5 vs. 54.1±9.2, p=0.001). 그리고 NT1에서 심한 무호흡증이 관찰되었으며(apnea-hypopnea index [AHI] [/h], 21.4±24.5 vs. 8.6±9.7, p=0.002) 높은 각성지수와(arousal index [/h], 27.3±18.4 vs. 14.3±7.2, p=0.001) 낮은 수면효율(sleep efficiency [%], 83.1±11.6 vs. 88.4±9.4, p=0.01)을 보여 야간 수면의 질이 불량한 것을 알 수 있었다. 야간 수면다원검사 시행 다음 날 시행한 MSLT 결과에서 평균 수면 잠복기는 차이가 없었고(mean sleep latency [min], 2.9±2.6 vs. 3.6±2.9, p=0.19) SOREMP은 유의하게 NT1에서 높았다(SOREM, 3.4±1.2 vs. 3.0±1.0, p=0.04). 총 기록된 SOREMP은 535회였으며 W-R은 137회 관찰되었다. 그중에 NT1은 108회(32.8%), NT2는 29회(14.1%)였다. N1-R은 260회 관찰되었으며 NT1이 158회(48.0%)였고 NT2가 102회(49.5%)였다. N2-R은 138회 관찰되었으며 NT1이 63회(19.1%), NT2가 75회(36.4%)였다(p<0.001).
다중 수면 잠복기검사의 수면단계전환 및 시간분포 특성MSLT 검사에서 W-R의 수면 단계 전환이 최소 1회 관찰되는지에 대해 확인하였다. 연구에 포함된 총 MSLT는 166회였으며 nap은 827회였다. NT1에서 최소 1회 이상 W-R이 확인된 MSLT 횟수가 43회였으며 NT1 환자들이 시행한 전체 MSLT의 45.7%였다. NT2는 25% (18회)의 MSLT에서 W-R이 관찰되었다. 통계적으로는 혼합효과모델 분석 결과 NT1에서 W-R이 관찰될 확률이 NT2에 비해 대략 3배 유의하게 높았다(odds ratio=3.04, p=0.012) (Fig. 1).
기면병 아형에 따른 수면단계전환의 특성 뿐만 아니라 전체 기면병에서 W-R 수면 단계 전환의 특성은 평균 수면 잠복기와 SOREMP 간의 상관관계로 확인하였다(Table 2). 평균 수면 잠복기는 W-R이 최소 1회 이상 관찰되었던 MSLT에서 유의미하게 역 상관관계를 보였으나(estimate -0.9185, p=0.04) W-R의 횟수와는 관련성이 없었다(p=0.15). SOREM은 MSLT에서 최소 1회 이상 W-R이 있을 경우 유의하게 횟수가 높았으며(estimate 1.1925, p<0.001), W-R 횟수가 증가함에 따라 SOREM도 빈도도 늘어나는 것을 알 수 있었다(estimate 0.3630, p<0.001).
고 찰본 연구에서는 NT1과 NT2의 수면 단계 전환 양상의 차이를 통해 병태생리학적인 특성을 이해하고자 하였다. 결과에서 NT2에 비해 NT1에서 W-R의 전환이 관찰되는 MSLT의 빈도가 더 높으며 또한 W-R이 있는 경우 높은 빈도의 SOREM과 짧은 수면 잠복기가 관찰되는 것을 알 수 있었다. MSLT에서 수면 단계 전환에 대한 몇몇 연구에 따르면 NT1 환자의 92%가 MSLT에서 각성 또는 N1에서 REM으로의 수면 단계 전환이 있었으며 야간 수면다원검사에서는 57.1%의 NT1에서 관찰되었다. 이에 반해 NT2는 각각 69.4%와 12.8%, 정상인의 경우는 39.3%와 1.3%의 MSLT 및 야간 수면다원검사에서의 각성 또는 N1에서 REM으로의 수면 단계 전환이 관찰되었다[6]. 다른 연구에서도 유사한 결과를 보고하였는데, NT1에서 SOREMP 중 71%가 2단계 수면 전에 REM이 발생하는 수면 단계 순서를 보인 반면 NT2의 경우는 32%에 불과하다고 하였다[10]. 이러한 결과는 연구에 따라 그 비율이 다른 점을 고려해야 하겠으나 특히 NT1의 경우 각성 또는 N1에서 SOREMP으로 진행할 가능성이 다른 원인으로 인한 과다수면 환자에 비해 더 크다는 것을 보여준다. 이러한 수면 단계 전환의 특성에 대한 이전의 연구와 본 연구에서 확인된 W-R 전환의 의미도 같은 맥락이며, 이는 정상적인 수면 전환 과정을 방해하는 증가된 REM 수면 성향을 의미한다. NT1과 NT2의 진단에서 구별하는 중요한 요소인 탈력발작과 hypocretin 감소는 보다 더 손상된 NT1의 해부학적 병리를 나타내며 MSLT에서 W-R의 전환도 이러한 기전적 특성을 뒷받침하는 것으로 생각된다.
그러나 본 연구 결과에서 평균 수면 잠복기는 W-R과의 관련성이 SOREMP와 비교하였을 때 상대적으로 높지 않았다. 수면 부족 및 특발성 과다수면증과 같은 상태는 주로 수면 잠복기 감소를 나타내는 반면에[11,12], SOREMP의 변화는 기면병의 특성으로 알려져 있다[13]. 특발성 과다수면증은 점진적인 생리적 수면 시작을 경험하며, 이는 일반적으로 N1에서 각성과 수면 사이의 변동으로 나타난다. 이러한 점진적인 수면 시작은 특발성 과다수면증 환자들이 점차 잠에 들어가는 임상적 양상으로 발현하게 되며, 그로 인해 환자들은 “수면에 취한” 상태로 표현한다. 반면에, 기면병 환자들은 수면 시작이 갑작스럽게 발생하는 특성과 함께 강한 잠의 압력을 느끼며, 이는 대개 강렬하고 억제할 수 없는 잠의 공격 형태로 나타나게 된다. 이러한 기면병과 특발성 과다수면증과 같은 다른 과수면증을 유발하는 질환과의 기전적 차이는 임상적으로 주간 졸림의 다른 양상을 보이게 만들며 MSLT에서도 특징적인 지표의 차이가 발생한다[2,14].
MSLT 중 세 번째 낮잠에서 관찰되는 W-R은 NT1과 NT2를 구분하는 중요한 요소임을 알 수 있었다. 아직까지 기면에서 MSLT의 주간 시간적 특성에 대한 연구는 많지 않다. MSLT의 시간적 분포를 조사한 단일 연구에서는 NT1 환자 가 오전 동안 시행한 3회의 낮잠에서는 N3 수면을 거의 나타내지 않는 반면, 주로 네 번째 및 다섯 번째 낮잠과 야간에 N3가 관찰되는 특징을 보인다고 하였다[15]. 또한 다섯 번의 낮잠 동안 NT1와 다른 과수면증 사이에 N3 발생에 현저한 차이가 있었다. 그러나 SOREMP의 주간 시간적 분포에 대해서는 뚜렷한 의미를 제시하지 못한 한계가 있었다.
흥미롭게도 우리 연구에서 NT1은 NT2와 비교하였을 때 세 번째 낮잠에서 높은 W-R을 관찰하였다. 이 결과는 NT1과 NT2의 감별점에 대한 의미 뿐만 아니라 기면병의 병태생리에서 일주기 리듬 측면의 새로운 관점을 보여준다.
여러 연구에 따르면, hypocretin은 특징적인 일중 변동 및 일주기 리듬을 보여준다. 늦은 아침에서 이른 오후 사이에 hypocretin 농도는 점차 감소하며 최저점을 보이게 된다. 그 이후, 낮부터 서서히 다시 증가하여 새벽 1시경에는 농도가 가장 상승하고, 이후 수면 시간 동안 다시 점진적으로 감소하는 경향을 나타낸다[3,16]. 한편 식사 후의 대사 활동이나 혈류의 변화, 정오 무렵 나타나는 심부체온의 일시적인 저하는 주간 졸림을 유발하는 주요 생리적 요인으로 알려져 있다. 이와 관련하여, 주목할만한 부분은 이러한 졸림 현상이 대략적으로 MSLT에서의 세 번째 낮잠 시기와 상당히 일치한다는 것이다, 만약 이 시기의 졸림이 단순히 생리적 요인에 기인한다면, NT1과 NT2 간의 세 번째 낮잠의 MSLT 결과는 큰 차이를 보이지 않아야 할 것이다. 그러나 본 연구에서는 해당시기에 NT1과 NT2 간의 W-R 차이가 뚜렷했다. 이 결과를 통해 NT1에서의 hypocretin 결핍이 이 시기에 더욱 강조되어 나타나는 것을 추정할 수 있다. 이러한 패턴은 W-R의 발생과 hypocretin의 일주기 리듬 사이의 연관성을 강조하며, W-R이 렘 수면 경향성을 나타내는 중요한 지표임을 나타낸다.
본 연구의 가장 중요한 한계는 NT1의 진단이 탈력발작에 근거하였다는 점이다. 본 연구의 목적은 NT1과 NT2의 MSLT 검사를 통해 병태생리의 차이를 보고자 것이므로 정확한 진단을 통한 정확한 분류가 무엇보다 중요하다. 이것은 탈력발작의 주관적 평가가 NT1과 NT2의 분류에서 불일치를 초래할 수 있다는 점에서 잠재적인 약점임을 고려해야 한다. 또한 W-R은 REM 수면에 대한 성향을 나타내므로 hypocretin 농도와의 상관관계까지 확인한다면 진단적 도구로써 뿐만 아니라 기전적 이해의 의미에서 MSLT의 가치가 더 높아 질 수 있을 것이다. 그리고 후향적 분석 방법과 단일기관 자료에 기반하여 연구를 진행하였기 때문에 자료 수집 및 해석과 관련된 잠재적 편향과 일반화 가능성에 대한 한계점이 있다. 또한 NT1에서 AHI가 높아 동반된 수면질환의 분포에 다소 차이가 있다는 한계점이 있다. 본 연구 결과에서 NT1이 W-R의 빈도가 더 높았고 SOREMP이 W-R과 관련성이 높다는 것을 고려하였을 때 비록 NT1에서 수면무호흡증의 동반빈도가 더 높다 하더라도 임상적 양상과 병태생리는 렘 조절장애가 미치는 영향이 더 크다는 것을 시사하나 해석에는 다소 주의를 요한다. 따라서 이 부분에 대해서는 추후 기면병과 수면무호흡증 간의 상호 관련성에 대한 추가적인 연구가 필요할 것이다.
그럼에도 불구하고 비교적 많은 기면병 환자를 대상으로 연구가 진행되었고 이전에 W/N1→R을 주로 근거로 하여 보고된 연구와는 달리 W→R의 특성을 보다 더 명확히 했다는 강점이 있다. 또한 5회 반복해야 하는 MSLT 특성 및 MSLT를 여러 번 시행한 환자가 있다는 점은 다계층적인 자료이고 이에 적절한 분석 방법을 적용해서 얻은 결과인 만큼 기면병 환자의 REM 조절의 의미를 밝히는 데 조금 더 도움이 되었을 것으로 생각한다.
결론적으로 본 연구에서는 MSLT의 수면 전환단계를 통해 NT1과 NT2의 REM 경향성의 차이 및 시간 분포 특성을 확인하였다. 정상적인 과정을 거치지 않고 빠르게 REM 수면으로 전환되는 것은 해부학적 병태생리가 심한 것을 시사하며 향후 REM 조절장애의 추가적인 이해를 위해 뇌척수액 hypocretin과 함께 추가적인 연구가 필요할 것이다.
Notes
Conflicts of Interest
Eun Yeon Joo, a contributing editor of the Journal of Sleep Medicine, was not involved in the editorial evaluation or decision to publish this article. All authors have declared no conflicts of interest.
Author Contributions
Conceptualization: Eun Yeon Joo. Data curation: Sujin Lee, Min Jae Seong. Formal analysis: Eun Yeon Joo. Investigation: Min Jae Seong, Eun Yeon Joo. Methodology: Min Jae Seong, Eun Yeon Joo. Project administration: Eun Yeon Joo. Resources: Eun Yeon Joo. Software: Min Jae Seong. Supervision: Eun Yeon Joo. Validation: Min Jae Seong, Eun Yeon Joo. Visualization: Sujin Lee, Min Jae Seong. Writing—original draft: Sujin Lee, Min Jae Seong. Writing—review & editing: Min Jae Seong.
Fig. 1.Distinctions in the occurrence of transitions from waking to REM sleep between narcolepsy type 1 and type 2. This figure indicates a threefold higher likelihood of W-R sleep transition in narcolepsy type (NT) 1 compared to type 2. REM, rapid eye movement. 
Fig. 2.Comparison of waking to REM transition during nap by narcolepsy type (NT). In patients with NT1, the frequency of wakefulness to REM (W-R) transitions during naps was consistently higher compared to those with NT2, particularly during the third nap where the difference was significantly greater. REM, rapid eye movement. 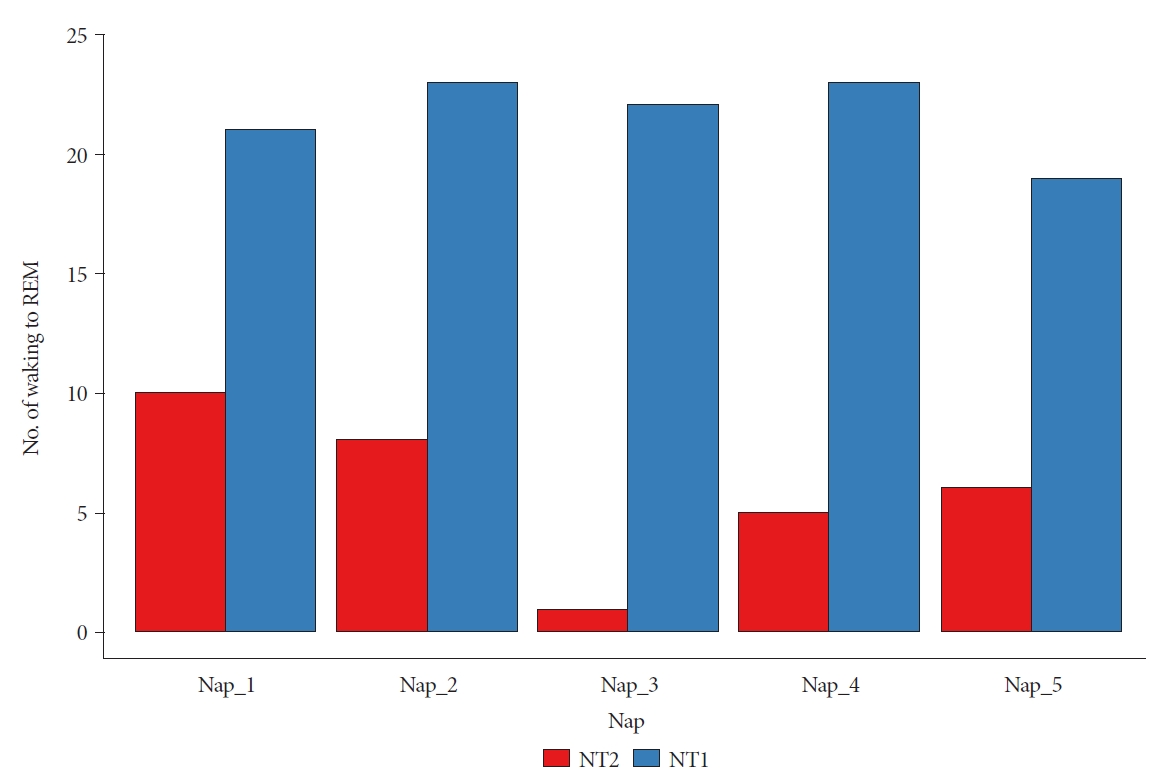
Table 1.Comparing demographic and sleep test characteristics in narcolepsy type 1 and type 2 patients Values are presented as mean±standard deviation or n (%). Sleep stage transitions among two distinct groups, labeled NT1 and NT2, are detailed in the table. Presented values denote both the frequency of each transition and the corresponding percentage, calculated based on the total transitions observed within each respective group. BMI, body mass index; ESS, Epworth sleepiness scale; PSQI, Pittsburgh Sleep Quality Index; ISI, insomnia severity index; KBDI2, Korean-Beck depression inventory-II; TST, total sleep time; REM, rapid eye movement; WASO, wakefullness after sleep onset; AHI, apnea-hypopnea index; RDI, respiratory disturbance index; ODI, oxygen desaturation index; PLMi, periodic limb movement index; MAi, movement arousal index; SOREM, sleep onset REM period; NREM, non-REM; NT, narcolepsy type Table 2.Effects of wake to REM sleep transitions on sleep parameters in patients with narcolepsy type 1 and type 2 Table 3.Temporal distribution differences of waking to REM transitions in multiple sleep latency test between narcolepsy type 1 and type 2 REFERENCES1. American Academy of Sleep Medicine. The international classification of sleep disorders: diagnostic and coding manual. 2nd ed. Westchester: American Academy of Sleep Medicine, 2005.
3. Mignot E, Lammers GJ, Ripley B, et al. The role of cerebrospinal fluid hypocretin measurement in the diagnosis of narcolepsy and other hypersomnias. Arch Neurol 2002;59:1553-1562. https://doi.org/10.1001/archneur.59.10.1553.
4. Nishino S, Ripley B, Overeem S, Lammers GJ, Mignot E. Hypocretin (orexin) deficiency in human narcolepsy. Lancet 2000;355:39-40. https://doi.org/10.1016/s0140-6736(99)05582-8.
5. Ruoff C, Pizza F, Trotti LM, et al. The MSLT is repeatable in narcolepsy type 1 but not narcolepsy type 2: a retrospective patient study. J Clin Sleep Med 2018;14:65-74. https://doi.org/10.5664/jcsm.6882.
6. Liu Y, Zhang J, Lam V, et al. Altered sleep stage transitions of REM sleep: a novel and stable biomarker of narcolepsy. J Clin Sleep Med 2015;11:885-894. https://doi.org/10.5664/jcsm.4940.
7. Marti I, Valko PO, Khatami R, Bassetti CL, Baumann CR. Multiple sleep latency measures in narcolepsy and behaviourally induced insufficient sleep syndrome. Sleep Med 2009;10:1146-1150. https://doi.org/10.1016/j.sleep.2009.03.008.
8. Drakatos P, Suri A, Higgins SE, et al. Sleep stage sequence analysis of sleep onset REM periods in the hypersomnias. J Neurol Neurosurg Psychiatry 2013;84:223-227. https://doi.org/10.1136/jnnp-2012-303578.
9. Sateia MJ. International classification of sleep disorders-third edition: highlights and modifications. Chest 2014;146:1387-1394. https://doi.org/10.1378/chest.14-0970.
10. Murer T, Imbach LL, Hackius M, et al. Optimizing MSLT specificity in narcolepsy with cataplexy. Sleep 2017;40:zsx173. https://doi.org/10.1093/sleep/zsx173.
11. Mitler MM, Gujavarty KS, Browman CP. Maintenance of wakefulness test: a polysomnographic technique for evaluating treatment efficacy in patients with excessive somnolence. Electroencephalogr Clin Neurophysiol 1982;53:658-661. https://doi.org/10.1016/0013-4694(82)90142-0.
12. Pizza F, Vandi S, Detto S, et al. Different sleep onset criteria at the multiple sleep latency test (MSLT): an additional marker to differentiate central nervous system (CNS) hypersomnias. J Sleep Res 2011;20(1 Pt 2):250-256. https://doi.org/10.1111/j.1365-2869.2009.00808.x.
13. Pizza F, Franceschini C, Peltola H, et al. Clinical and polysomnographic course of childhood narcolepsy with cataplexy. Brain 2013;136(Pt 12):3787-3795. https://doi.org/10.1093/brain/awt277.
14. Rosenberg RS, Van Hout S. The American Academy of Sleep Medicine inter-scorer reliability program: sleep stage scoring. J Clin Sleep Med 2013;9:81-87. https://doi.org/10.5664/jcsm.2350.
15. Mayà G, Gaig C, Iranzo A, Santamaria J. Temporal distribution of sleep onset REM periods and N3 sleep in the MSLT and night polysomnogram of narcolepsy type 1 and other hypersomnias. Sleep Med 2023;102:32-38. https://doi.org/10.1016/j.sleep.2022.12.018.
16. Salomon RM, Ripley B, Kennedy JS, et al. Diurnal variation of cerebrospinal fluid hypocretin-1 (Orexin-A) levels in control and depressed subjects. Biol Psychiatry 2003;54:96-104. https://doi.org/10.1016/s0006-3223(02)01740-7.
|
|
|||||||||||||||||||||||||||||||||||