ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀ(rapid eye movement sleep behavior disorder)ļŖö ļĀśņłśļ®┤ ļÅÖņĢł ņĀĢņāüņĀüņ£╝ļĪ£ ļ░£ņāØĒĢśļŖö Ļ│©Ļ▓®ĻĘ╝ņØś ļ¼┤ĻĖ┤ņןņ”Ø(atonia)ņØ┤ ņåīņŗżļÉśņ¢┤, Ļ┐łņØś ļé┤ņÜ®Ļ│╝ Ļ┤ĆļĀ©ļÉ£ ņøĆņ¦üņ×äņØ┤ ļéśĒāĆļéśļŖö Ļ▓āņØä ĒŖ╣ņ¦Ģņ£╝ļĪ£ ĒĢ£ļŗż. ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀļŖö ĒŖ╣ļ│äĒĢ£ ņøÉņØĖņØä ņ░ŠņØä ņłś ņŚåļŖö ĒŖ╣ļ░£ņä▒Ļ│╝ ņ”ØĒøäņä▒ņ£╝ļĪ£ ļéśļłī ņłś ņ׳ļŗż. ļīĆļČĆļČäņØś ņ”ØĒøäņä▒ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀļŖö ĻĖ░ļ®┤ņ”Ø, ļ¦īņä▒ ņ¦äĒ¢ēņä▒ ņ¦łĒÖśņØĖ ĒīīĒé©ņŖ©ļ│æ, ļĀłļ╣äņåīņ▓┤ņ╣śļ¦ż(dementia with lewy bodies), ļŗżĻĖ░Ļ┤Ćņ£äņČĢņ”Ø(multiple system atrophy) ļō▒ņØś ļŗżļźĖ ņ¦łĒÖśĻ│╝ ņŚ░Ļ┤ĆļÉśņ¢┤ ļ░£ņāØĒĢ£ļŗż.1-3 ĒĢśņ¦Ćļ¦ī ĻĖēņä▒ ļśÉļŖö ņĢäĻĖēņä▒ ņżæņČöņŗĀĻ▓ĮĻ│ä ņןņĢĀļĪ£ ņØĖĒĢ┤ ļ░£ņāØĒĢśĻĖ░ļÅä ĒĢ£ļŗż. ņŚ¼ĻĖ░ņŚÉļŖö ņŻ╝ļĪ£ ļćīĻ░äņØä ņ╣©ļ▓öĒĢśļŖö ļćīņØś ĻĄ¼ņĪ░ņĀüņØĖ ļ│æļ│ĆņØ┤ ņ׳Ļ▒░ļéś, ņżæņČöņŗĀĻ▓ĮĻ│äņ¦łĒÖśņ£╝ļĪ£ ļćīņŚ╝ņØ┤ļéś ĻĖĖļף-ļ░öļĀłņ”ØĒøäĻĄ░ ļō▒ņØ┤ ņ׳ņØä ņłś ņ׳Ļ│Ā,4 ņĢĮļ¼╝(tricyclic antidepressant, selective serotonin reuptake inhibitor, selective serotonin and noradrenaline reuptake inhibitor, monoamine oxidase inhibitor, beta-adrenergic blocker)ņØś ņé¼ņÜ® Ēś╣ņØĆ ņżæļŗ©ņŚÉ ņØśĒĢ┤ ņ£Āļ░£ļÉśļŖö Ļ▓ĮņÜ░ļÅä ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. ņØ┤ ņżæ ļćīņŚ╝ ņØ┤ĒøäņŚÉ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ļ░£ņāØĒ¢łļŗżļŖö ļ│┤Ļ│ĀļŖö ņäĖĻ│äņĀüņ£╝ļĪ£ļÅä ļō£ļ¼╝ļŗż. ļö░ļØ╝ņä£ ņĀĆņ×ÉļōżņØĆ ļćīņŚ╝ņ£╝ļĪ£ ņØĖĒĢ┤ ņĀäļ░śņĀüņØĖ ļćīĻĖ░ļŖźņןņĢĀĻ░Ć ļ░£ņāØĒĢ£ Ēøä ņØ┤ļĪ£ ņØĖĒĢ┤ Ļ░ĆņŚŁņĀüņØĖ ņłśļ®┤ĒĢ┤ļ”¼ņÖĆ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ļ░£ņāØĒĢ£ ņäĖ Ļ░Ćņ¦Ć ņ”ØļĪĆļź╝ Ļ┤Ćņ░░ĒĢśņśĆĻ│Ā, ņØ┤ņŚÉ ļīĆĒĢ£ ĻĄŁļé┤ ļ│┤Ļ│ĀĻ░Ć ņŚåņ¢┤ ņØ┤ļź╝ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ņ”Ø ļĪĆ
ņ”Ø ļĪĆ 1
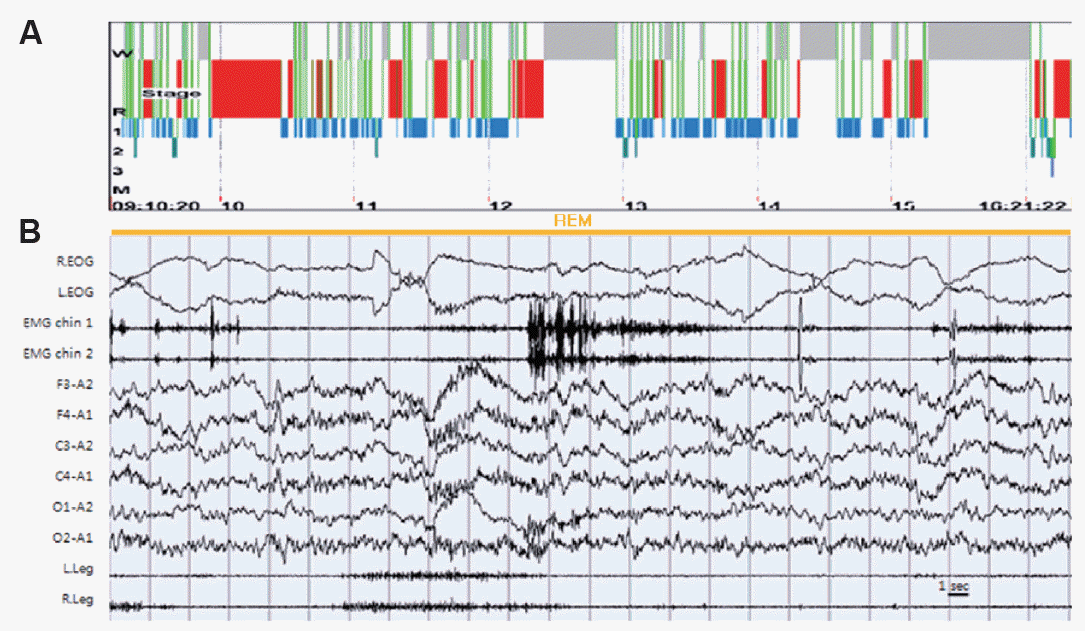
27ņäĖ ņŚ¼ņ×ÉĻ░Ć ņĪ░ņĀłļÉśņ¦Ć ņĢŖļŖö ļ░£ņ×æņØä ņŻ╝ņåīļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. ļé┤ņøÉ ļŗ╣ņŗ£ ņŗ£Ē¢ēĒĢ£ ņŗĀĻ▓ĮĒĢÖņĀü Ļ▓Ćņé¼ņāü ļŗ©ņł£ ņ¦Ćņŗ£ ņé¼ĒĢŁņŚÉ ļö░ļź╝ ņłś ņ׳ļŖö ņĀĢļÅäņØś Ļ▓Įļ»ĖĒĢ£ ņØśņŗØ ņĀĆĒĢśļź╝ ļ│┤ņØ┤ļ®░, ņ¢æņĖĪ ņāüĒĢśņ¦ĆņØś ļ¦łļ╣äĻ░Ć ņ׳ņ¢┤ ņāüņ¦ĆļŖö motor grade IV, ĒĢśņ¦ĆļŖö motor grade IIIļĪ£ ņĖĪņĀĢļÉśņŚłĻ│Ā, Ļ▓Įņ¦üņØ┤ ļÅÖļ░śļÉśņŚłļŗż. Ļ│╝Ļ▒░ļĀźņŚÉņä£ ĒŖ╣ņØ┤ ļ│æļĀźņØĆ ņŚåņŚłļŗż. ļé┤ņøÉ 40ņØ╝ ņĀäļČĆĒä░ ļæÉĒåĄņØ┤ ļ░£ņāØĒĢśņśĆĻ│Ā, ņĢĮ ĒĢ£ ļŗ¼ ņĀäļČĆĒä░ ņØĖņ¦ĆņןņĢĀņÖĆ Ēś╝ļÅł, ĒÖśĻ░ü ņ”ØņāüņØ┤ ļ░£ņāØĒĢśņŚ¼ ĒāĆņøÉņŚÉ ņ×ģņøÉĒĢśņśĆļŗż. ņ×ģņøÉ ļŗ╣ņØ╝ļČĆĒä░ ņĀäņŗĀņØś Ļ░Ģņ¦üĻ░äļīĆļ░£ņ×æņ¢æņāüņ£╝ļĪ£ 10ļČäĻ░ä ļ░£ņ×æņØ┤ ļ░£ņāØĒĢśņśĆĻ│Ā ļ░£ņ×æņØĆ 3ņŗ£Ļ░ä Ļ░äĻ▓®ņŚÉņä£ 40ļČä Ļ░äĻ▓®ņ£╝ļĪ£ ļ╣łļÅäĻ░Ć Ļ░ÉņåīĒĢśļ®┤ņä£ ļ░£ņ×æ ņé¼ņØ┤ņŚÉ ņØśņŗØ ĒśĖņĀäņØ┤ ņŚåņ¢┤ ļćīņĀäņ”Øņ¦ĆņåŹņ”Øņ£╝ļĪ£ ņ¦äļŗ© Ēøä ĒĢŁļćīņĀäņ”ØņĀ£ļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ļŗ╣ņŗ£ ļćīņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņŚÉņä£ļŖö ņØ┤ņāüņåīĻ▓¼ņØ┤ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśĻ│Ā, ņ”Øņāü ļ░£ņāØ 2ņŻ╝ ļÆżņŚÉ ņŗ£Ē¢ēĒĢ£ ļćīņ▓ÖņłśņĢĪ Ļ▓Ćņé¼ņŚÉņä£ ņĢĢļĀź 23 cmH2O, ļ░▒ĒśłĻĄ¼ 66/╬╝L, ļ”╝ĒöäĻĄ¼ 66%, ņĀüĒśłĻĄ¼ 1/╬╝L, ļŗ╣ 70 mg/dL, ļ¦Éņ┤łĒśłņĢĪļŗ╣ 109 mg/dLļĪ£ ļ░öņØ┤ļ¤¼ņŖżņä▒ ļćīņŚ╝ņ£╝ļĪ£ ņ¦äļŗ©ĒĢśņŚ¼ acyclovirļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ņ”Øņāü ļ░£ņāØ ĒĢ£ ļŗ¼ ļÆżņŚÉ ņŗ£Ē¢ēĒĢ£ ļćīņ▓ÖņłśņĢĪ Ļ▓Ćņé¼ņāü ņØ┤ņĀäņŚÉ ļ│┤ņØ┤ļŹś ļćīņ▓ÖņłśņĢĪ ņäĖĒżņ”ØĻ░Ćņ”Ø ņåīĻ▓¼ņØ┤ ĒśĖņĀäļÉśņŚłļŗż. ņ×ģņøÉ ņżæ ņŗ£Ē¢ēĒĢ£ ļćīĒīīņŚÉņä£ļŖö ņä£ĒīīĻ░Ć Ļ┤Ćņ░░ļÉśņŚłĻ│Ā, ļ░£ņ×æļ░®ņĀä(ictal discharge)ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ņ¦ĆņåŹņĀü ļ░£ņŚ┤ņØ┤ ņ׳ņ¢┤ ņŗ£Ē¢ēĒĢ£ ļ│ĄļČĆ ņ╗┤Ēō©Ēä░ļŗ©ņĖĄ ņ┤¼ņśüņāüņŚÉņä£ ņśżļźĖņ¬Į ļé£ņåīņŚÉ ĻĖ░ĒśĢņóģ(teratoma)ņØ┤ ļ░£Ļ▓¼ļÉśņŚłĻ│Ā ĒĢŁ-N-Methyl-D-Aspartate(NMDA) ņłśņÜ®ņ▓┤ļćīņŚ╝ Ļ░ĆļŖźņä▒ņØ┤ Ļ░Ćņן ļåÆņØä Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņśĆļŗż. ĒĢŁļćīņĀäņ”ØņĀ£ļŖö ņä£ņä£Ē׳ ņżäņŚ¼ ļéśĻ░öņ£╝ļéś ĒÖśņ×ÉļŖö ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņØĖņŗØņØ┤ ņŚåņŚłĻ│Ā, ņé¼ņ¦ĆĻ░Ć ļ╗Żļ╗ŻĒĢ£ ļ¬©ņŖĄ, ņ×ģņØä Ļ│äņåŹ ņśżļ¼╝Ļ▒░ļ”¼Ļ│Ā ļłłņØä Ļ╣£ļ╣ĪņØ┤ļŖö ļ¬©ņŖĄņØä ļ│┤ņŚ¼ Ļ│ĀņÜ®ļ¤ē ņŖżĒģīļĪ£ņØ┤ļō£ļź╝ ļæÉ ņ░©ļĪĆ ņé¼ņÜ®ĒĢśņśĆĻ│Ā, ņ×ģņøÉ ĒĢ£ ļŗ¼ņ¦ĖļČĆĒä░ ņŻ╝ņ£ä ņāüĒÖ®ņŚÉ ļ░śņØæņØä ļ│┤ņØ┤ĻĖ░ ņŗ£ņ×æĒ¢łĻ│Ā, ļæÉ ļŗ¼ņ¦ĖļČĆĒä░ ļ¬ģļĀ╣ņłśĒ¢ēņØ┤ Ļ░ĆļŖźĒ¢łĻ│Ā ļīĆĒÖöļź╝ ĒĢĀ ņłś ņ׳ņŚłļŗż. ņäĖ ļŗ¼ņ¦ĖļČĆĒä░ ņØśņé¼ņåīĒåĄņØ┤ Ļ░ĆļŖźĒ¢łĻ│Ā, ņןĻĖ░Ļ░ä ņ╣©ņāüņāØĒÖ£ļĪ£ ņØĖĒĢ£ ņé¼ņ¦Ć ņ£äņĢĮņŚÉ ļīĆĒĢ┤ ņ×¼ĒÖ£ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśņśĆļŗż. ņ×ģņøÉ ļäż ļŗ¼ņ¦ĖļČĆĒä░ ļ░żņŚÉ ņל ļĢī ņ×ĀĻ╝¼ļīĆļź╝ ĒĢśĻ│Ā, ļłłņØä ļ£©Ļ│Ā ļÅīņĢäļŗżļģöĻ│Ā, ņśĘņØä ļ▓ŚĻ│Ā ļŗżļźĖ ņé¼ļ×ī ņ╣©ļīĆņŚÉ Ļ░Ćņä£ ņä£ ņ׳ļŖö ļō▒ņØś ņØ┤ņāü Ē¢ēļÅÖņØä ļ│┤ņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ Ē¢ēļÅÖņØä ĒĢ£ Ļ▓āņØä ņĢäņ╣©ņŚÉļŖö ĻĖ░ņ¢ĄĒĢśņ¦Ć ļ¬╗ĒĢśņśĆĻ│Ā ņāüĻĖ░ ņ”ØņāüņØĆ ļ¦żņØ╝ ļ░żļ¦łļŗż ļ░£ņāØĒĢśņśĆļŗż. ņłśļ®┤ņןņĢĀļź╝ ņØśņŗ¼ĒĢśņŚ¼ ņłśļ®┤ļŗżņøÉĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż(Fig. 1). ņłśļ®┤ļŗżņøÉĻ▓Ćņé¼ Ļ▓░Ļ│╝ņāü ņłśļ®┤ņ×Āļ│ĄĻĖ░ļŖö 0ļČäņ£╝ļĪ£ ļŗ©ņČĢļÉśņ¢┤ ņ׳ņŚłĻ│Ā, Ļ▓Ćņé¼ņŗ£Ļ░ä 425ļČä ņżæ 258ļČä ļÅÖņĢł ņłśļ®┤ņØä ņĘ©ĒĢśņŚ¼, ņłśļ®┤ĒÜ©ņ£©(sleep efficiency)ņØĆ 60.5%ļĪ£ Ļ░ÉņåīļÉśņ¢┤ ņ׳ņŚłļŗż. ņłśļ®┤ ņżæ Ļ░üņä▒ņ¦Ćņłś(arousal index)Ļ░Ć 9.79 /hņśĆĻ│Ā, ņŻ╝ļĪ£ ļ¼┤ĒśĖĒØĪĻ│╝ ļÅÖļ░śļÉśņ¢┤ Ļ╣©Ļ▒░ļéś ĒŖ╣ļ│äĒĢ£ ņØ┤ņ£Ā ņŚåņØ┤ Ļ╣©ļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄņĢśļŗż. ļ¼┤ĒśĖĒØĪ-ņĀĆĒśĖĒØĪņ¦Ćņłś(apnea-hypopnea index)ļŖö 12.8 /hļĪ£ Ļ▓ĮļÅäņØś ņłśļ®┤ļ¼┤ĒśĖĒØĪņ”ØņØ┤ ņ׳ņŚłļŗż. ņłśļ®┤ĻĄ¼ņĪ░ņŚÉņä£ļŖö N1ņłśļ®┤Ļ│╝ ļĀśņłśļ®┤ņØ┤ Ļ░üĻ░ü 57.6%, 37.7%ļĪ£ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłĻ│Ā, N2ņÖĆ N3ņłśļ®┤ņØĆ Ļ░üĻ░ü 4.27%, 0.39%ļĪ£ Ļ░ÉņåīļÉśņ¢┤ ņ׳ņŚłļŗż. ņłśļ®┤ĻĄ¼ņĪ░Ļ░Ć ĒīīĻ┤┤ļÉśņ¢┤ N1ņłśļ®┤, ļĀśņłśļ®┤, Ļ░üņä▒ņØ┤ ņŻ╝ĻĖ░ņĀüņ£╝ļĪ£ ļ░śļ│ĄļÉśņŚłļŗż. ļĀśņłśļ®┤ ņżæ ņé¼ņ¦ĆņØś ņøĆņ¦üņ×äņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, Ēä▒ ĻĘ╝ĻĖ┤ņןņØś ņ”ØĻ░Ć(REM sleep without atonia)ļź╝ ļÅÖļ░śĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ņåīĻ▓¼ņØä ņóģĒĢ®ĒĢśņśĆņØä ļĢī ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀļĪ£ ņ¦äļŗ©ĒĢĀ ņłś ņ׳ņŚłļŗż. Ēü┤ļĪ£ļéśņĀ£Ēī£(clonazepam)ņØä ņé¼ņÜ®ĒĢśļ®┤ņä£ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀļŖö ņä£ņä£Ē׳ ĒśĖņĀäļÉśļŖö Ļ▓ĮĻ│╝ļĪ£ ĒāĆņøÉņ£╝ļĪ£ ņĀäņøÉĒĢśņśĆļŗż. ļ░£ļ│æ 1ļģä ļÆżņŚÉ ĻĖ░ņ¢ĄļĀźņØĆ ņĀĢņāüņØ┤Ļ│Ā Ļ▓ĮļĀ©ņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļ®░ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀļÅä ĒśĖņĀäļÉśņ¢┤ ĒĢŁĻ▓ĮļĀ©ņĀ£ņÖĆ Ēü┤ļĪ£ļéśņĀ£Ēī£ņØä ņżæļŗ©ĒĢśņśĆļŗż. ņØ┤Ēøä 1ļģäĻ░ä ņČöņĀüĻ┤Ćņ░░ ĒĢśņśĆņ£╝ļéś ņ”ØņāüņØś ņ×¼ļ░£ņØĆ ņŚåņŚłļŗż.
ņ”Ø ļĪĆ 2
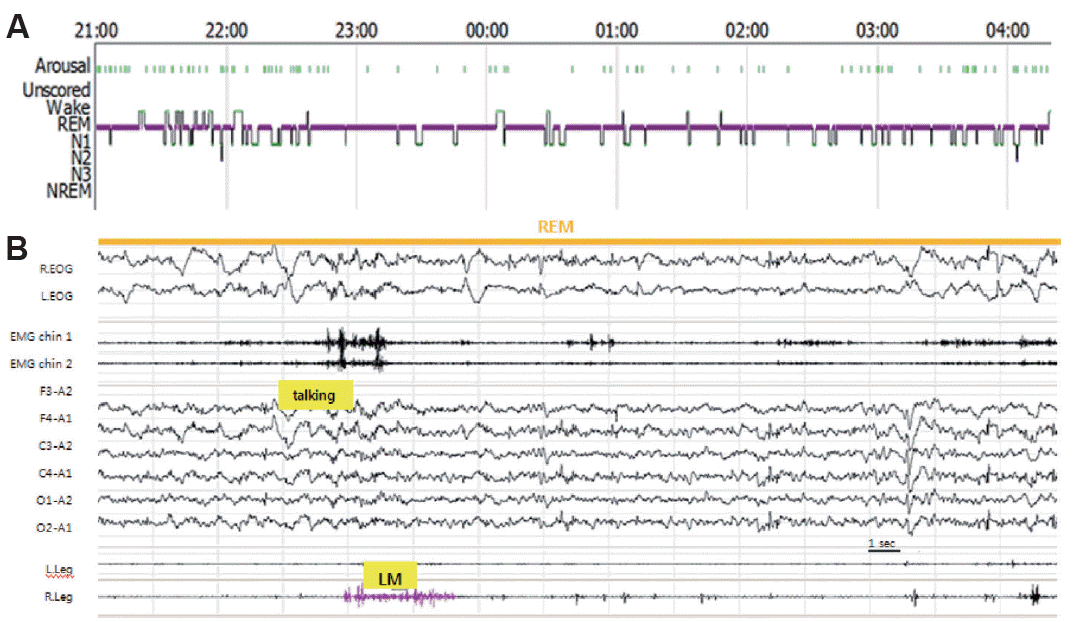
40ņäĖ ļé©ņ×ÉĻ░Ć Ē¢ēļÅÖņØ┤ņāüņØä ņŻ╝ņåīļĪ£ ņØæĻĖēņŗżļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. Ļ│╝Ļ▒░ļĀźņāü Ļ░æņāüņāśņ£ĀļæÉņĢöņóģ(thyroid papillary cancer)ņ£╝ļĪ£ Ļ░æņāüņäĀņĀäņĀłņĀ£ņłĀņØä ļ░øņĢśļŹś ļ│æļĀźņØ┤ ņ׳ņŚłļŗż. ĒÖśņ×ÉļŖö ļé┤ņøÉ ĒĢ£ ļŗ¼ ņĀäņŚÉ ļæÉĒåĄĻ│╝ ļ░£ņŚ┤ņØ┤ ļÅÖļ░śļÉśņ¢┤ ĒāĆņøÉņŚÉ ņ×ģņøÉĒĢśņśĆĻ│Ā, ļŗ╣ņŗ£ ņŗ£Ē¢ēĒĢ£ ļćīņ▓ÖņłśņĢĪĻ▓Ćņé¼ņāü ļ░▒ĒśłĻĄ¼ 289/╬╝L, ļ”╝ĒöäĻĄ¼ 66%, ļŗ©ļ░▒ņ¦ł 91 mg/dL, ļŗ╣ 53 mg/dL, ļ¦Éņ┤łĒśłņĢĪļŗ╣ 118 mg/dL, ņĢäļŹ░ļģĖņŗĀ ĒāłņĢäļ»ĖļģĖĒÜ©ņåī(adenosine deaminase, ADA) 2.9 U/LļĪ£ ĒÖĢņØĖļÉśņŚłļŗż. ļćīņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņŚÉņä£ļŖö Ļ▓Įļ»ĖĒĢ£ ņŚ░ņłśļ¦ē(leptomeninges)ņØś ņĪ░ņśüņ”ØĻ░ĢņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņāüĻĖ░ ņåīĻ▓¼ņ£╝ļĪ£ ļ░öņØ┤ļ¤¼ņŖżņä▒ ņłśļ¦ēņŚ╝ņ£╝ļĪ£ ņ¦äļŗ© Ēøä ņłśņĢĪņ╣śļŻīļź╝ ĒĢśņśĆļŗż. ļé┤ņøÉ 2ņŻ╝ ņĀäļČĆĒä░ ņØ┤ņĀäņŚÉ ļ╣äĒĢ┤ Ļ│Āņ¦æņØ┤ ņäĖņ¦ĆļŖö ņä▒Ļ▓®ļ│ĆĒÖöļź╝ ļ│┤ņśĆņ£╝ļ®░, ĒśäņŗżĻ│╝ ļ╣äĒśäņŗżņØä Ēś╝ļÅłĒĢśņśĆĻ│Ā, ĒÖśĻ░üņ”ØņāüņØ┤ ļ░£ņāØĒĢśņśĆļŗż. ņØ┤ņŚÉ ļ░öņØ┤ļ¤¼ņŖżņä▒ ļćīņŚ╝ņ£╝ļĪ£ ņ¦äļŗ© Ēøä acyclovirļź╝ Ēł¼ņŚ¼ĒĢśņśĆļŗż. ļŗżņŗ£ ņŗ£Ē¢ēĒĢ£ ļćīņ▓ÖņłśņĢĪĻ▓Ćņé¼ņŚÉņä£ ļ░▒ĒśłĻĄ¼ļŖö 68/╬╝LļĪ£ Ļ░ÉņåīĒĢśņśĆņ¦Ćļ¦ī ADAĻ░Ć 4.5 U/LļĪ£ ņØ┤ņĀäļ│┤ļŗż ņ”ØĻ░ĆļÉśņ¢┤ Ļ▓░ĒĢĄņä▒ ļćīņŚ╝ ņØśņŗ¼ĒĢśņŚÉ ĒĢŁĻ▓░ĒĢĄņĀ£ļź╝ ņŗ£ņ×æĒĢśņśĆļŗż. ļé┤ņøÉ ņØ╝ņŻ╝ņØ╝ ņĀäļČĆĒä░ ņä£ņä£Ē׳ ļ¦ÉņØä ļ¬╗ĒĢśļŹöļŗł ņĀäĒśĆ ļ¦ÉņØä ĒĢśņ¦Ć ļ¬╗ĒĢśņśĆĻ│Ā, ņ¢╝ĻĄ┤ņØ┤ ņøĆņ░öĻ▒░ļ”¼ļŖö ņØ┤ņāüņÜ┤ļÅÖņØ┤ ļ░£ņāØĒĢśņŚ¼ ļ│ĖņøÉņ£╝ļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. ļŗ╣ņŗ£ ņŗ£Ē¢ēĒĢ£ ņŗĀĻ▓ĮĒĢÖņĀü Ļ▓Ćņé¼ņŚÉņä£ ļ¬ģļĀ╣ņłśĒ¢ēņØĆ 2ļŗ©Ļ│äĻ╣īņ¦Ć Ļ░ĆļŖźĒĢśņśĆĻ│Ā, ņØśņŗØņØĆ ļ¬ģļŻīĒĢśņśĆņ£╝ļéś ļ¦ÉņØä ņĀäĒśĆĒĢśņ¦Ć ļ¬╗Ē¢łĻ│Ā, ņŗ¼ĒĢ£ ņŚ░ĒĢśņןņĢĀĻ░Ć ļÅÖļ░śļÉśņ¢┤ ņ׳ņŚłļŗż. Ļ░äĒŚÉņĀüņ£╝ļĪ£ ņ×ģ ņŻ╝ņ£äņÖĆ ņé¼ņ¦ĆņŚÉņä£ ĻĘ╝Ļ░äļīĆĻ▓ĮļĀ©(myoclonus)ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ļćīĒīīņŚÉņä£ ņżæņŗ¼ļČĆ(central area)ņŚÉņä£ Ļ░äĒŚÉņĀüņØĖ ĻĘ╣ĒīīĻ░Ć Ļ┤Ćņ░░ļÉśņ¢┤ ĒĢŁļćīņĀäņ”ØņĀ£ļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ļŗżņŗ£ ņŗ£Ē¢ēĒĢ£ ļćīņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņØś ņĢĪņ▓┤Ļ░ÉņćĀņŚŁņĀäĒÜīļ│Ąņśüņāü(fluid attenuated inversion recovery image)ņŚÉņä£ Ļ│Āļ×æ(sulcus)ņØä ļö░ļØ╝ Ļ│ĀņØīņśüņØ┤ Ļ┤Ćņ░░ļÉśņ¢┤ ņŚ░ņłśļ¦ēņŚ╝(leptomeningitis) ņåīĻ▓¼ņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņśĆļŗż. ļČĆņóģņ¢æņ”ØĒøäĻĄ░ Ļ┤ĆļĀ© ļćīņŚ╝Ļ│╝ ņ×ÉĻ░Ćļ®┤ņŚŁņ¦łĒÖś Ļ┤ĆļĀ© ļćīņŚ╝ņØä Ļ░Éļ│äĒĢ┤ņŻ╝ĻĖ░ ņ£äĒĢ┤ ņĢö ņäĀļ│äĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, ņ×ÉĻ░Ćļ®┤ņŚŁ ĒĢŁņ▓┤ļōżņØä Ļ▓Ćņé¼ĒĢśņśĆņ¦Ćļ¦ī ĒŖ╣ņØ┤ņåīĻ▓¼ņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ņØ┤Ēøä ņ”ØņāüņØś ņØ╝ņżæļ│ĆļÅÖņØĆ ņ׳ņŚłņ¦Ćļ¦ī ĒśĖņĀäĻ▓ĮĻ│╝ļĪ£ ļŗżņŗ£ Ļ░äļŗ©ĒĢ£ ļ¦ÉņØä ĒĢśĻĖ░ ņŗ£ņ×æĒĢśņśĆĻ│Ā, ņ×ģņøÉ 2ņŻ╝ņ¦ĖļČĆĒä░ ņĀĢņāüņĀüņ£╝ļĪ£ ļ¦ÉņØä ĒĢĀ ņłś ņ׳ņŚłļŗż. ņ×ģņøÉ 16ņØ╝ņ¦ĖļČĆĒä░ ņłśļ®┤ ņżæņŚÉ ĒŚøņåÉņ¦łĻ│╝ ļ¬ĖņØä ņøĆņ¦üņØ┤ļ®░ ļ¦ÉņØä ĒĢśļŖö ļ¬©ņŖĄņØ┤ ļ¦żņØ╝ļ░ż Ļ┤Ćņ░░ļÉśņ¢┤ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀļź╝ Ļ░Éļ│äĒĢśĻĖ░ ņ£äĒĢ┤ ņłśļ®┤ļŗżņøÉĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż(Fig. 2). ņłśļ®┤ņ×Āļ│ĄĻĖ░ļŖö 32.1ļČäņ£╝ļĪ£ ņĀĢņāüņØ┤ņŚłĻ│Ā, Ļ▓Ćņé¼ņŗ£Ļ░ä 442ļČä ņżæ 425ļČä ļÅÖņĢł ņłśļ®┤ņØä ņĘ©ĒĢśņŚ¼, ņłśļ®┤ĒÜ©ņ£©ņØĆ 96%ļĪ£ ņĀĢņāüņØ┤ņŚłļŗż. ņłśļ®┤ ņżæ Ļ░üņä▒ņ¦ĆņłśĻ░Ć 16.9 /hņśĆĻ│Ā, ņŻ╝ļĪ£ ņŻ╝ĻĖ░ņé¼ņ¦ĆņÜ┤ļÅÖĻ│╝ ļÅÖļ░śļÉśņ¢┤ Ļ╣©Ļ▒░ļéś ĒŖ╣ļ│äĒĢ£ ņØ┤ņ£Ā ņŚåņØ┤ Ļ╣©ļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄņĢśļŗż. ļ¼┤ĒśĖĒØĪ-ņĀĆĒśĖĒØĪņ¦ĆņłśļŖö 2.3 /hļĪ£ ņĀĢņāüņØ┤ņŚłļŗż. ņłśļ®┤ĻĄ¼ņĪ░ņŚÉņä£ļŖö N1ņłśļ®┤ņØĆ 6.7%ļĪ£ ņĀĢņāüņØ┤ņŚłĻ│Ā, N2ņÖĆ N3ņłśļ®┤ņØĆ Ļ░üĻ░ü 12.4%, 0.2%ļĪ£ Ļ░ÉņåīļÉśņ¢┤ ņ׳ņŚłļŗż. ļĀśņłśļ®┤ņØĆ 87.4%ļĪ£ ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłļŗż. ļĀśņłśļ®┤ ņżæ ņé¼ņ¦ĆņØś ņøĆņ¦üņ×äņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, Ēä▒ ĻĘ╝ĻĖ┤ņןņØś ņ”ØĻ░ĆĻ░Ć ņ¦ĆņåŹņĀüņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ ņåīĻ▓¼ņØä ņóģĒĢ®ĒĢśņśĆņØä ļĢī ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀļĪ£ ņ¦äļŗ©ĒĢĀ ņłś ņ׳ņŚłļŗż. Ēü┤ļĪ£ļéśņĀ£Ēī£ņØä ņé¼ņÜ®ĒĢśļ®┤ņä£ ņłśļ®┤ ņżæ ļ¦ÉĒĢśļŖö ņ”ØņāüĻ│╝ ĒŚøņåÉņ¦łĒĢśļŖö Ļ▓āņØ┤ ņé¼ļØ╝ņĪīļŗż. Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ņżæ ņ”Øņāü ņŚåņ¢┤ ņé¼ņÜ®ĒĢśļŹś ĒĢŁļćīņĀäņ”ØņĀ£ņÖĆ Ēü┤ļĪ£ļéśņĀ£Ēī£ņØä ļ¬©ļæÉ ļüŖņŚłĻ│Ā, ņØ┤Ēøä 1ļģäĻ░ä ņČöņĀüĻ┤Ćņ░░ ĒĢśņśĆņ£╝ļéś ņ×¼ļ░£ņåīĻ▓¼ņØĆ ņŚåņŚłļŗż.
ņ”Ø ļĪĆ 3
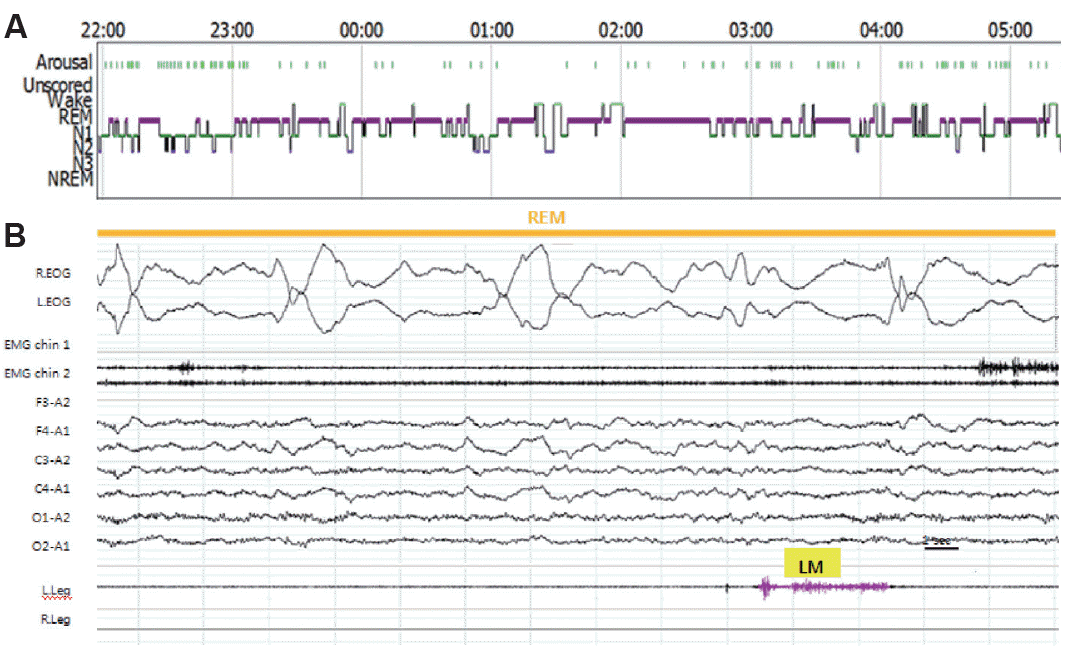
21ņäĖ ņŚ¼ņ×ÉĻ░Ć Ē¢ēļÅÖņØ┤ņāüņØä ņŻ╝ņåīļĪ£ ņØæĻĖēņŗżļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. Ļ│╝Ļ▒░ļĀźņŚÉņä£ 7ņäĖ ļĢī ļćīņłśļ¦ēņŚ╝ņØä ņĢōņØĆ ņĀüņØ┤ ņ׳ņŚłņ£╝ļéś ņØśņŗØļ│ĆĒÖöļŖö ņŚåņŚłĻ│Ā, Ļ│¦ ĒÜīļ│ĄļÉśņŚłļŗż. ļé┤ņøÉ ĒĢ£ ļŗ¼ ņĀäļČĆĒä░ ņŗ¼ĒĢ£ ļČłņĢłĻ░ÉĻ│╝ ļČłļ®┤ņ”ØņØ┤ ļ░£ņāØĒĢśņśĆĻ│Ā ļīĆļŗĄņØä ņל ĒĢśņ¦Ć ņĢŖņ£╝ļ®░ ņāüĒÖ®ņŚÉ ļ¦×ņ¦Ć ņĢŖļŖö Ē¢ēļÅÖņØä ĒĢśļŖö Ļ▓āņØ┤ ņ×ÉņŻ╝ Ļ┤Ćņ░░ļÉśņŚłļŗż. ļæÉĒåĄĻ│╝ ņŗ¼Ļ│äĒĢŁņ¦äņØä ĒśĖņåīĒĢśņśĆĻ│Ā ņ¢┤ļ¢ż ļ¦ÉņØä ĒĢ┤ļÅä ņŖ¼ĒöäĻ▓ī ņÜ░ļŖö ļ¬©ņŖĄņØä ļ│┤ņŚ¼ ĒāĆņøÉ ņĀĢņŗĀĻ│╝ņŚÉ ņ×ģņøÉĒĢśņśĆļŗż. ņ×ģņøÉ ņżæ ņĢäĒīīĒŖĖĻ░Ć ļ¼┤ļäłņ¦ĆļŖö Ļ┐łņØä ĻŠ╝ ņØ┤ĒøäņŚÉ ŌĆśņŚäļ¦ł ņĢäļ╣ĀļŖö ņé┤ņĢäņĢ╝ ĒĢ┤ŌĆÖļØ╝ļŖö ļ¦ÉņØä ļ░śļ│ĄĒĢśļ®░ Ļ┤┤ņä▒ņØä ņ¦Ćļź┤ļŖö ļ¬©ņŖĄņØ┤ ļ░śļ│ĄļÉśņŚłļŗż. ĒÖśņ▓Ł, ĒÖśņŗ£, ņÜ░ņÜĖ, ņ×Éņé┤ņāØĻ░üņØ┤ ņ׳ņŚłĻ│Ā, ĒĢśļŻ©ņŚÉ 1~2ĒÜī ļ®ŹĒĢ┤ņ¦Ćļ®┤ņä£ ņé¼ņ¦ĆĻ░Ć ļ╗Żļ╗ŻĒĢ┤ņ¦ĆĻ│Ā ĒåĄņ”ØņŚÉ ļ░śņØæņØ┤ ņŚåļŖö ļ¬©ņŖĄņØ┤ 30~40ļČäĻ░ä ņ¦ĆņåŹļÉśņŚłļŗż. ļćīņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüĻ│╝ ļćīĒīīĻ▓Ćņé¼, ļćīņ▓ÖņłśņĢĪĻ▓Ćņé¼ļŖö ņĀĢņāü ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż. ļ│ĖņøÉ ņĀĢņŗĀĻ│╝ļĪ£ ļé┤ņøÉĒĢśņŚ¼ ņĀĢņŗĀļČäņŚ┤ņ”Ø(schizophrenia)ņØś ĻĖ┤ņןņ”ØĒśĢ(catatoniatype)ņ£╝ļĪ£ ņ¦äļŗ© Ēøä ņĀäĻĖ░Ļ▓ĮļĀ©ņÜöļ▓Ģ(elctroconvulsive therapy)ņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņ×ģņøÉ ņżæņŚÉ ņé¼ņ¦ĆņØś Ļ░Ģņ¦üĻ░äļīĆņä▒ ņøĆņ¦üņ×äņØ┤ 1~2ļČä ņ¦ĆņåŹļÉśĻ│Ā ņØ┤Ēøä ņłśļ®┤ņØä ņĘ©ĒĢśļŖö ļ¬©ņŖĄņØ┤ ĒĢśļŻ©ņŚÉ 2~3ĒÜī ļ╣łļÅäļĪ£ ļ░£ņāØĒĢśņśĆĻ│Ā 1ņŗ£Ļ░äņŚÉ 4~5ĒÜīĻ╣īņ¦Ć ļ╣łļÅäĻ░Ć ņĀÉņĀÉ ņ”ØĻ░ĆĒĢśņśĆļŗż. ņäĖ ļ▓łņ¦Ė ņĀäĻĖ░Ļ▓ĮļĀ©ņÜöļ▓Ģ ņŗ£Ē¢ē Ēøä ņÖ╝ņ¬Į ļŗżļ”¼ņŚÉņä£ ņŗ£ņ×æĒĢśņŚ¼ ņ¢æņ¬Į ļŗżļ”¼ņŚÉ ĻĘ╝Ļ░äļīĆĻ▓ĮļĀ©ņØ┤ ņ׳ņŚłĻ│Ā, ļłłņØ┤ ņÖ╝ņ¬Įņ£╝ļĪ£ ņ╣śņÜ░ņ│É ņ׳ņŚłĻ│Ā, Ļ│ĀĻ░£ļÅä ņÖ╝ņ¬Įņ£╝ļĪ£ ĒÜīņĀäļÉśņŚłļŗż. ļ░£ņ×æ Ēøä ĒåĀļō£ļ¦łļ╣ä(ToddŌĆÖs paralysis)Ļ░Ć ņÖ╝ņ¬Įņ£╝ļĪ£ ļ░£ņāØĒĢśņśĆĻ│Ā ņØ┤Ēøä ņłśļ®┤ņØä ņĘ©Ē¢łļŗż. ļ╣łļÅäļŖö 1ņŗ£Ļ░äņŚÉ 7~8ņ░©ļĪĆņśĆĻ│Ā, ņ¦ĆņåŹņŗ£Ļ░äņØĆ 10~15ņ┤łņśĆļŗż. ĒĢŁļćīņĀäņ”ØņĀ£ļź╝ ņé¼ņÜ®ĒĢśņśĆĻ│Ā 24ņŗ£Ļ░ä ļćīĒīī ļ¬©ļŗłĒä░ļ¦üņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļćīĒīīņāüņŚÉņä£ ļ╣łļ▓łĒĢśĻ▓ī ņśżļźĖņ¬Į ļ░śĻĄ¼ņŚÉņä£ ņŗ£ņ×æļÉśļŖö ļ░£ņ×æļ░®ņĀäņØ┤ Ļ┤Ćņ░░ ļÉśņŚłĻ│Ā, ļćīņĀäņ”Øņ¦ĆņåŹņ”Øņ£╝ļĪ£ ņ¦äļŗ© Ēøä ņżæĒÖśņ×ÉņŗżņŚÉņä£ ĒĢŁļćīņĀäņ”ØņĀ£ļź╝ ņČöĻ░ĆĒĢśņŚ¼ ņé¼ņÜ®ĒĢśņśĆļŗż. ļŗżņŗ£ ņŗ£Ē¢ēĒĢ£ ļćīņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņŚÉņä£ļŖö Ļ▓ĮĒĢ£ ņŚ░ņłśļ¦ē ņĪ░ņśüņ”ØĻ░ĢņØ┤ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā, ļćīņ▓ÖņłśņĢĪ Ļ▓Ćņé¼ļŖö ņĀĢņāüņØ┤ņŚłļŗż. ņøÉņØĖļČłļ¬ģņØś ļćīņŚ╝ņ£╝ļĪ£ ņ¦äļŗ©ĒĢśņśĆĻ│Ā, acyclovirļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ņØ┤Ēøä Ļ▓ĮļĀ©ņØä ņĪ░ņĀłĒĢśļ®┤ņä£ ĒÖśņ×É ņØśņŗØņłśņżĆņØ┤ ņĀĢņāüņØĖ ņŗ£Ļ░äņØ┤ ļŖśņ¢┤ļéśĻ│Ā ļ░£ņ×æļ╣łļÅäĻ░Ć Ļ░ÉņåīĒĢśņŚ¼ ņ×ģņøÉ 49ņØ╝ņ¦Ė ņØ╝ļ░śļ│æļÅÖņ£╝ļĪ£ ņĀäļÅÖĒĢśņśĆļŗż. ņØ┤Ēøä ņŗØņØ┤ ļ░Å ņ×¼ĒÖ£ņ╣śļŻīļź╝ ņ¦äĒ¢ēĒĢśļ®┤ņä£ ĒÖśņ×ÉņÖĆ ņĀĢņāüņĀüņØĖ ļīĆĒÖöĻ░Ć Ļ░ĆļŖźĒĢ┤ņĪīĻ│Ā, ņØśņŗØņłśņżĆņØ┤ ņØ┤ņĀäņ▓śļ¤╝ ĒÜīļ│ĄļÉ£ ņāüĒā£ļĪ£ Ēć┤ņøÉĒĢśņśĆļŗż. ņ”Øņāü ļ░£ņāØ 3Ļ░£ņøö Ēøä ņ×Éļ®┤ņä£ ņ×ĀĻ╝¼ļīĆļź╝ ĒĢśĻ│Ā Ļ┐łĻŠĖļŖö Ļ▓āņ▓śļ¤╝ Ē¢ēļÅÖĒĢśļŖö ņ”ØņāüņØ┤ ĒĢśļŻ╗ļ░żņŚÉ 1~2ņ░©ļĪĆ, ļ¦żņØ╝ ļ░£ņāØĒĢśņŚ¼ ņłśļ®┤ļŗżņøÉĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż(Fig. 3). ņłśļ®┤ļŗżņøÉĻ▓Ćņé¼ņāü ņłśļ®┤ņ×Āļ│ĄĻĖ░ļŖö 0.6ļČäņ£╝ļĪ£ Ļ░ÉņåīļÉśņ¢┤ ņ׳ņŚłĻ│Ā, Ļ▓Ćņé¼ņŗ£Ļ░ä 453ļČä ņżæ 429ļČä ļÅÖņĢł ņłśļ®┤ņØä ņĘ©Ē¢łĻ│Ā, ņłśļ®┤ĒÜ©ņ£©ņØĆ 94.6%ļĪ£ ņĀĢņāüņØ┤ņŚłļŗż. ņłśļ®┤ ņżæ Ļ░üņä▒ņ¦ĆņłśĻ░Ć 20.4 /hļĪ£ ņĢĮĻ░ä ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłĻ│Ā, ĒŖ╣ļ│äĒĢ£ ņØ┤ņ£Ā ņŚåņØ┤ Ļ╣©ļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄņĢśļŗż. ļ¼┤ĒśĖĒØĪ-ņĀĆĒśĖĒØĪņ¦ĆņłśļŖö 1.4 /hļĪ£ ņĀĢņāüņØ┤ņŚłļŗż. ņłśļ®┤ĻĄ¼ņĪ░ņŚÉņä£ļŖö N1ņłśļ®┤ņØĆ 33.1%ļĪ£ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłĻ│Ā, N2ņÖĆ N3ņłśļ®┤ņØĆ Ļ░üĻ░ü 5.6%, 0.0%ļĪ£ Ļ░ÉņåīļÉśņ¢┤ ņ׳ņŚłļŗż. ļĀśņłśļ®┤ņØĆ 61.3%ļĪ£ ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłļŗż. ļĀśņłśļ®┤ ņżæ ņé¼ņ¦ĆņØś ņøĆņ¦üņ×äņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, Ēä▒ ĻĘ╝ĻĖ┤ņןņØś ņ”ØĻ░ĆĻ░Ć ņ¦ĆņåŹņĀüņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ ņåīĻ▓¼ņØä ņóģĒĢ®ĒĢśņśĆņØä ļĢī ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀļĪ£ ņ¦äļŗ©ĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ņŚÉ Ēü┤ļĪ£ļéśņĀ£Ēī£ņØä ņé¼ņÜ®ĒĢśņśĆĻ│Ā, ņ”Øņāü ĒśĖņĀäļÉśņ¢┤ 3Ļ░£ņøö ņØ┤ĒøäļČĆĒä░ļŖö Ēü┤ļĪ£ļéśņĀ£Ēī£ ņé¼ņÜ®ņØä ņżæļŗ©ĒĢśņśĆļŗż. ņØ┤Ēøä 7Ļ░£ņøöĻ░ä ņČöņĀüĻ┤Ćņ░░ ĒĢśņśĆņ£╝ļéś ņ×¼ļ░£ņåīĻ▓¼ņØĆ ņŚåņŚłļŗż.
Ļ│Ā ņ░░
ņØĖĻ░äņØś ņłśļ®┤ņØĆ ļĀśņłśļ®┤Ļ│╝ ļ╣äļĀśņłśļ®┤ņ£╝ļĪ£ ļéśļē£ļŗż. ņĀĢņāü ņä▒ņØĖņØś ļ░ż ņłśļ®┤ņŚÉņä£ 4~6ĒÜīņØś ļ╣äļĀś-ļĀśņłśļ®┤ ņŻ╝ĻĖ░Ļ░Ć ļ░śļ│ĄļÉśļ®░, ļīĆĻ░£ ņłśļ®┤ņØĆ ļ╣äļĀśņłśļ®┤ņ£╝ļĪ£ ņŗ£ņ×æĒĢśĻ│Ā, ņłśļ®┤ņŗ£ņ×æ Ēøä 80~100ļČäņŚÉ ņ▓½ļ▓łņ¦Ė ļĀśņłśļ®┤ņØ┤ ļéśĒāĆļé£ļŗż. ĻĘĖ Ēøä ļ╣äļĀśņłśļ®┤Ļ│╝ ļĀśņłśļ®┤ņØ┤ 90ļČäņØä ņŻ╝ĻĖ░ļĪ£ ļ░śļ│ĄĒĢ£ļŗż. ņĀĢņāüņä▒ņØĖņØś ļ░ż ņłśļ®┤ņØś ņĢĮ 70~80%ļŖö ļ╣äļĀśņłśļ®┤ņØ┤Ļ│Ā, 20~25%ļŖö ļĀśņłśļ®┤ņØ┤ļŗż. ļĀśņłśļ®┤ņØ┤ ļ░£ņāØĒĢśļŖö Ļ││ņØĆ ļŗżļ”¼ļćī(pons)ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. ļĀśņłśļ®┤ņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö ĻĄ¼ņĪ░ļ¼╝ņØĆ ļæÉ Ļ░Ćņ¦ĆļĪ£ ļéśļłī ņłś ņ׳ļŗż. ĻĖēņåŹņĢłĻĄ¼ņÜ┤ļÅÖ(REM)ņØä ļ░£ņāØņŗ£ĒéżļŖö Ļ││Ļ│╝ ĻĖēņåŹņĢłĻĄ¼ņÜ┤ļÅÖņØä ņ¢ĄņĀ£ĒĢśļŖö Ļ││ņØ┤ļŗż. ņØ┤ ļæÉ Ļ││ņØś ņāüĒśĖņ×æņÜ®ņŚÉ ņØśĒĢ┤ ļĀśņłśļ®┤ņØ┤ ļ░£ņāØĒĢśļŖö ņŻ╝ĻĖ░Ļ░Ć ĒśĢņä▒ļÉ£ļŗż. ĻĖēņåŹņĢłĻĄ¼ņÜ┤ļÅÖņØä ļ░£ņāØņŗ£ĒéżļŖö Ļ││(REM-on)ņØĆ sublaterodorsal nucleusņÖĆ ņØĖņĀæĒĢ┤ņ׳ļŖö preceruleus regionņØ┤ļŗż. ņØ┤Ļ││ņØ┤ ĒÖ£ņä▒ĒÖöļÉśļ®┤ ļæÉ Ļ░Ćņ¦Ć Ļ▓ĮļĪ£ļĪ£ ņŗĀĒśĖļź╝ ļ│┤ļé┤Ļ│Ā ĒĢ£ ņŗĀĒśĖļŖö ĻĖ░ņĀĆņĢ×ļćī(basal forebrain)ļĪ£ Ļ░Ćņä£ Ļ┐łņØä ĻŠĖĻ▓ī ĒĢśĻ│Ā ļśÉ ĒĢśļéśņØś ņŗĀĒśĖļŖö ņĢäļלļĪ£ ļé┤ļĀżĻ░Ć ņł©ļćīņé¼ņØ┤ņŗĀĻ▓Į(medullar interneuron)Ļ│╝ ņ▓Öņłśņé¼ņØ┤ņŗĀĻ▓Į(spinal interneuron)ņØä ĒÖ£ņä▒ĒÖöņŗ£ņ╝£ ņ▓ÖņłśņØś ņĢīĒīīņÜ┤ļÅÖņŗĀĻ▓Į(alphamotor neuron)ņØä ņ¢ĄņĀ£ĒĢśņŚ¼ Ļ┐łņØä ĻŠĖļŖö ļÅÖņĢł ļ¼┤ĻĖ┤ņןņ”Ø(atonia)ņØä ņ£Āņ¦ĆĒĢ┤ņżĆļŗż. ļĀśņłśļ®┤ņØä ņ¢ĄņĀ£ĒĢśļŖö Ļ││(REM-off)ņØĆ ļ░░Ļ░Ćņ¬ĮņłśĻ┤ĆņŻ╝ļ│ĆĒÜīņāēņ¦ł(ventrolateral periaqueductal gray matter)Ļ│╝ Ļ░Ćņ¬Įļŗżļ”¼ļćīļŹ«Ļ░£(lateral pontine tegmentum)ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. ļĀśņłśļ®┤ņØä ņ¢ĄņĀ£ĒĢśļŖö Ļ││(REM-off)ņØä ņ¢ĄņĀ£ĒĢśļŖö ņŗĀĒśĖļŖö ļ░░Ļ░Ćņ¬Įņŗ£Ļ░üĻĄÉņ░©ņĢ×ĒĢĄ(ventrolateral preoptic nucleus), ņĮ£ļ”░ņä▒ņÖĖļ░░ņĖĪļŹ«Ļ░£ĒĢĄ(laterodorsal tegmental nuclei)Ļ│╝ ļīĆļćīļŗżļ”¼ļŗżļ”¼ļćīļŹ«Ļ░£ĒĢĄ(pedunculopontine tegmental nuclei)ņØ┤Ļ│Ā ĒĢŁņ¦äņŗ£ĒéżļŖö ņŗĀĒśĖļŖö ņśżļĀēņŗĀ ņŗĀĻ▓ĮņäĖĒż(orexin neuron), ļ¬©ļģĖņĢäļ»╝Ļ│äņØś ņ▓Łņāēļ░śņĀÉ(locus ceruleus)Ļ│╝ ļō▒ņ¬ĮņåöĻĖ░ĒĢĄ(dorsal raphe nucleus)ņØ┤ ņ׳ļŗż. ļ╣äļĀśņłśļ®┤ņØĆ ĒŖ╣ņĀĢņ£äņ╣śņŚÉņä£ ļ░£ņāØĻĖ░Ļ░Ć ņĪ┤ņ×¼ĒĢśĻĖ░ļ│┤ļŗżļŖö ļćīņżäĻĖ░, ņé¼ņØ┤ļćī, ņĢ×ļćīņØś ņŚ¼ļ¤¼ ņäĖĒżļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ä ļäżĒŖĖņøīĒü¼ņŚÉ ņØśĒĢ┤ ņØ┤ļŻ©ņ¢┤ņ¦ĆļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņŚ¼ņ¦äļŗż.
ļīĆļČĆļČäņØś ņ”ØĒøäņä▒ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀļŖö ņĢīĒīī-ņŗ£ļłäĒü┤ļĀłņØĖļ│æņ”Ø(╬▒-synucleinopathy) ļō▒ņØś Ēć┤Ē¢ēņä▒ņŗĀĻ▓ĮĻ│ä ņ¦łĒÖś ļśÉļŖö ĻĖ░ļ®┤ņ”ØĻ│╝ ņŚ░Ļ┤ĆļÉśņ¢┤ ļ░£ņāØĒĢ£ļŗż. ĒĢśņ¦Ćļ¦ī ļō£ļ¼╝Ļ▓īļŖö ĻĖēņä▒ ļśÉļŖö ņĢäĻĖēņä▒ņ£╝ļĪ£ ļĀśņłśļ®┤ņןņĢĀĻ░Ć ļ░£ņāØĒĢśļŖö Ļ▓ĮņÜ░ļÅä ņ׳Ļ│Ā, ņóģņ¢æ, ļćīĒśłĻ┤ĆņןņĢĀ ļō▒ņ£╝ļĪ£ ņØĖĒĢ┤ ļ░£ņāØĒĢ£ ļćīņżäĻĖ░(brainstem)ļź╝ ņ╣©ļ▓öĒĢśļŖö ĻĄ¼ņĪ░ņĀüņØĖ ļ│æļ│ĆņØ┤ļéś ļćīņŚ╝, ĻĖĖļ×æļ░öļĀłņ”ØĒøäĻĄ░ ļō▒ņØś ņżæņČöņŗĀĻ▓ĮĻ│ä ņ¦łĒÖś, ņĢĮļ¼╝, ņĢīņĮöņś¼ņżæļÅģ ļō▒Ļ│╝ ņŚ░Ļ┤ĆļÉśņ¢┤ ļ░£ņāØĒĢśĻĖ░ļÅä ĒĢ£ļŗż. ĻĄ¼ņĪ░ņĀü ļ│æļ│Ćņ£╝ļĪ£ ņØĖĒĢ£ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀļŖö ņŻ╝ļĪ£ ļō▒Ļ░Ćņ¬Įļŗżļ”¼ļćī(dorsolateralpons)ļéś ņĀĢņżæņł©ļćī(median medulla)ņŚÉ ņ£äņ╣śĒĢśļŖö ļ│æļ│ĆņØ┤ ņ׳ņØä ļĢī ļ░£ņāØĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņל ņĢīļĀżņĀĖ ņ׳ļŗż.
ļćīņŚ╝ ņØ┤ĒøäņŚÉ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ļ░£ņāØĒ¢łļŗżļŖö ļ│┤Ļ│ĀļŖö ņäĖĻ│äņĀüņ£╝ļĪ£ļÅä ļō£ļ¼╝ļŗż. Iranzo ļō▒ņØĆ 5ļ¬ģņØś ņĀäņĢĢņØśņĪ┤ĒśĢ ņ╣╝ļź©ĒåĄļĪ£ĒĢŁņ▓┤(voltage gated potassium channel antibody)ņŚÉ ņØśĒĢ£ ļæśļĀłļćīņŚ╝(limbic encephalitis) ĒÖśņ×ÉņŚÉņä£ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ļ░£ņāØĒ¢łļŗżļŖö ļ│┤Ļ│Āļź╝ ĒĢśņśĆļŗż.5 ņØ┤ļōż ļ¬©ļæÉ ņ×äņāüņåīĻ▓¼ ļ░Å ņśüņāüĒĢÖņĀüņ£╝ļĪ£ ļćīņżäĻĖ░ļź╝ ņ╣©ļ▓öĒĢ£ ņåīĻ▓¼ņØ┤ ņŚåņŚłļŗż. ļćīĒīīņāüņŚÉņä£ ņĖĪļæÉņŚĮņŚÉņä£ ļ░£ņ×æĒīīĻ░Ć Ļ┤Ćņ░░ļÉśņŚłĻ│Ā, ļćīņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņØś ņĢĪņ▓┤Ļ░ÉņćĀņŚŁņĀäĒÜīļ│ĄņśüņāüņŚÉņä£ ļé┤ņĖĪļæÉņŚĮņØś Ļ│ĀņØīņśüņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņØ┤ ņ”ØļĪĆļ│┤Ļ│ĀņŚÉņä£ļŖö ļæśļĀłĻ│ä(limbic system)ņØś ņåÉņāüņØ┤ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀņØś ļ░£ņāØĻĖ░ņĀäņŚÉ ņ¦üņĀæņĀü ļśÉļŖö ļćīņżäĻĖ░ņØś ļĀśņłśļ®┤ ņĪ░ņĀłņŚÉ ņśüĒ¢źņØä ļ»Ėņ│É Ļ░äņĀæņĀüņ£╝ļĪ£ ĻĖ░ņŚ¼Ē¢łņØä Ļ░ĆļŖźņä▒ņØä ņŻ╝ņןĒĢśņśĆļŗż. ĒĢŁļćīņĀäņ”ØņĀ£ņÖĆ ļ®┤ņŚŁĻĖĆļĪ£ļČłļ”░ ņ╣śļŻī Ēøä ņØ┤ļōż ņżæ 3ļ¬ģņØĆ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀ ņ”ØņāüņØ┤ ņÖäņĀäĒ׳ ĒÜīļ│ĄļÉśņŚłĻ│Ā, 2ļ¬ģņØĆ ļČĆļČäņĀüņ£╝ļĪ£ ĒśĖņĀäļÉśņŚłļŗż. CorneliusCorneliusļō▒ņØĆ ņĀäņĢĢņØśņĪ┤ĒśĢņ╣╝ļź©ĒåĄļĪ£ ĒĢŁņ▓┤ Ļ┤ĆļĀ© ļćīņŚ╝ ĒÖśņ×É 15ļ¬ģ ņżæ 14ļ¬ģņØś ĒÖśņ×É(95%)ņŚÉņä£ ņłśļ®┤ņןņĢĀĻ░Ć ļ░£ņāØĒ¢łĻ│Ā, ņØ┤ļōż ņżæ 7ļ¬ģņŚÉņä£ ņłśļ®┤ļŗżņøÉĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝ 2ļ¬ģņŚÉņä£ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż.6 ļśÉ ļŗżļźĖ ļ│┤Ļ│ĀļĪ£ļŖö ņøÉņØĖņØ┤ ļ░ØĒśĆņ¦Ćņ¦Ć ņĢŖņØĆ ļæśļĀłļćīņŚ╝ ĒÖśņ×ÉņŚÉņä£ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ļ░£ņāØĒĢ£ ņ”ØļĪĆ 1ļ¬ģņØ┤ ņ׳ļŗż.7 ĒĢŁ-Ma2 Ļ┤ĆļĀ© ļćīņŚ╝ ĒÖśņ×ÉņŚÉņä£ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀņÖĆ ĻĖ░ļ®┤ņ”ØņØ┤ ĒĢ©Ļ╗ś ļ░£ņāØĒĢ£ ņ”ØļĪĆ 1ļ¬ģņØĆ ļćīņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņŚÉņä£ ļō▒Ļ░Ćņ¬Į ņżæļćī(dorsolateral midbrain), ĒÄĖļÅä(amygdale), ņĀĢņżæĻ│üņŗ£ņāü(paramedianthalamus)ņØś ņåÉņāüņØ┤ Ļ┤Ćņ░░ļÉśņ¢┤ ļćīņżäĻĖ░(brainstem), ļæśļĀłĻ│ä(limbic system), ņŗ£ņāüĒĢśļČĆ(hypothalamic)ņØś ņåÉņāüņŚÉ ņØśĒĢ£ ņ”Øņāü ļ░£ņāØ Ļ░ĆļŖźņä▒ņŚÉ ļīĆĒĢ┤ ņ¢ĖĻĖēĒĢśņśĆļŗż.8 Limousin ļō▒ņØĆ ĻĖēņä▒ ļ¦łļ”äļćīņŚ╝(rhombencephalitis) ņØ┤ĒøäņŚÉ ņŗ¼ĒĢ£ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ļ░£ņāØĒĢ£ ņ”ØļĪĆļź╝ ļ│┤Ļ│ĀĒĢśņśĆļŗż.9 ņØ┤ ĒÖśņ×ÉņŚÉņä£ ņŗ£Ē¢ēĒĢ£ ļćīņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņŚÉņä£ļŖö ļŗżļ”¼ļćīļŹ«Ļ░£(pontine tegmentum)ņÖĆ ņł©ļćīņŚÉ ļ│æļ│ĆņØ┤ ņ׳ņŚłļŗż. ņłśļ®┤ļŗżņøÉĻ▓Ćņé¼ņāüņŚÉņä£ ļĀśņłśļ®┤ņØ┤ 39%ļĪ£ ņĀĢņāüļ│┤ļŗż ļŖśņ¢┤ļéś ņ׳Ļ│Ā REM ņłśļ®┤ ņżæ 44%ņŚÉņä£ ļ¼┤ĻĖ┤ņןņ”ØņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ĒĢŁ-NMDA ņłśņÜ®ņ▓┤ ĒĢŁņ▓┤ Ļ┤ĆļĀ© ļćīņŚ╝ņŚÉņä£ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ļ░£ņāØĒ¢łļŗżļŖö ņ”ØļĪĆļ│┤Ļ│ĀļŖö ņŚåņŚłņ£╝ļéś, Dalmau ļō▒ņØĆ ĒĢŁ-NMDA ņłśņÜ®ņ▓┤ ĒĢŁņ▓┤Ļ┤ĆļĀ© ļæśļĀłļćīņŚ╝ĒÖśņ×É 12ļ¬ģ ņżæ 4ļ¬ģņŚÉņä£ ņØ╝ņŗ£ņĀüņØĖ ņłśļ®┤ņןņĢĀĻ░Ć ļÅÖļ░śļÉśņŚłļŗżĻ│Ā ņ¢ĖĻĖēĒ¢łņ¦Ćļ¦ī ņłśļ®┤ļŗżņøÉĻ▓Ćņé¼ ļō▒ņØś ņČöĻ░ĆņĀüņØĖ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņ¦ĆļŖö ņĢŖņĢśļŗż.10
ņŚ¼ĻĖ░ņä£ ļ│┤Ļ│ĀĒĢ£ ņäĖ ņ”ØļĪĆņŚÉņä£ ļ¬©ļæÉ ļĀśņłśļ®┤ņØ┤ ņĀĢņāüņłśļ®┤ņØś 37~87%Ļ╣īņ¦Ć ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłĻ│Ā, ļĀśņłśļ®┤ņŗ£ņŚÉ ļ¼┤ĻĖ┤ņןņ”ØņØ┤ ņ£Āņ¦ĆļÉśņ¦Ć ņĢŖļŖö ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ļ░£ņāØĒĢśņśĆļŗż. ņØ┤ļŖö ļĀśņłśļ®┤ņØś ņĪ░ņĀłņŚÉ ņØ┤ņāüņØ┤ ņ׳ņ¢┤ REM-onņØś ĻĖ░ļŖź ņżæ ĒĢśļéśņØĖ ļ¼┤ĻĖ┤ņןņ”ØņØ┤ ņ£Āņ¦ĆļÉśņ¦Ć ņĢŖņĢä ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ļ░£ņāØĒĢśņśĆĻ│Ā, REM-offĻ░Ć ņĀĢņāüņĀüņ£╝ļĪ£ ņ×æļÅÖļÉśņ¦Ć ņĢŖņĢä ļĀśņłśļ®┤ņØ┤ ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ ļŖśņ¢┤ļéś ņ׳ņØīņØä ņØśļ»ĖĒĢ£ļŗż. REM-onĻ│╝ REM-off ļ¬©ļæÉņØś ĻĖ░ļŖźņןņĢĀĻ░Ć ņ׳ļŗżĻ│Ā ļ│╝ ņłś ņ׳ņ£╝ļ®░ ņØ┤ļŖö ļŗżļ”¼ļćīņØś ĻĄ¼ņĪ░ņĀü ņØ┤ņāüņØ┤ ņ׳ņØä ļĢī ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. ļŗżļźĖ Ļ░ĆļŖźņä▒ņ£╝ļĪ£ļŖö ļ╣äļĀśņłśļ®┤ņØ┤ ņĀĢņāüņĀüņ£╝ļĪ£ ļ░£ņāØĒĢśņ¦Ć ņĢŖņĢśņØä Ļ▓ĮņÜ░ņØ┤ļŗż. ļ╣äļĀśņłśļ®┤ņØĆ ĒŖ╣ņĀĢ ļ░£ņāØĻĖ░Ļ░Ć ņĢäļŗī ņĢ×ļćī(forebrain)ņØś ļäżĒŖĖņøīĒü¼ņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢśļ»ĆļĪ£ ņ”ØļĪĆļōżņŚÉņä£ņ▓śļ¤╝ Ļ┤æļ▓öņ£äĒĢ£ ņĢ×ļćīņØś ņåÉņāüņŚÉ ņØśĒĢ┤ ļ╣äļĀśņłśļ®┤ņØ┤ ņĀĢņāüņĀüņ£╝ļĪ£ ļ░£ĒśäĒĢśņ¦Ć ļ¬╗ĒĢśņŚ¼ ļĀśņłśļ®┤ņØ┤ ļ╣äņĀĢņāüņĀüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢĀ ņłś ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ņØ┤ Ļ░Ćņäżļ¦īņ£╝ļĪ£ļŖö ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ļ░£ņāØĒĢ£ Ļ▓āņØĆ ņäżļ¬ģļÉśņ¦Ć ņĢŖļŖöļŗż. ļćīņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāü ņåīĻ▓¼ņāü ņ”ØļĪĆ 1ņŚÉņä£ļŖö ņØ┤ņāü ņåīĻ▓¼ņØ┤ ņŚåņŚłĻ│Ā, ņ”ØļĪĆ 2, 3ņŚÉņä£ļŖö ņŚ░ņłśļ¦ēņØś ņĪ░ņśüņ”ØĻ░Ģ ņåīĻ▓¼ļ¦ī ņ׳ņ¢┤ ņäĖ ņ”ØļĪĆņŚÉņä£ ļ¬©ļæÉ ļŗżļ”¼ļćīņŚÉ ĻĄŁĒĢ£ļÉ£ ļ│æļ│ĆņØĆ ņŚåņŚłļŗż. ĒĢśņ¦Ćļ¦ī ņäĖ ņ”ØļĪĆ ļ¬©ļæÉ Ļ┤æļ▓öņ£äĒĢ£ ļćīņåÉņāüņØ┤ ņ׳ņŚłņØä Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśļ®░, ņØ┤ļĪ£ ņØĖĒĢ┤ ļ│Ąņ×ĪĒĢ£ ņłśļ®┤ņŻ╝ĻĖ░ņØś ĒśĢņä▒ņØ┤ ņĀ£ļīĆļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ņĢŖņĢä ņłśļ®┤ņŻ╝ĻĖ░Ļ░Ć ņĀĢņāüņĀüņ£╝ļĪ£ ĒśĢņä▒ļÉśņ¦Ć ņĢŖņĢśņ£╝ļ®░ ļĀśņłśļ®┤ ņżæņØś ļ¼┤ĻĖ┤ņןņ”ØņØ┤ ņ£Āņ¦ĆļÉśņ¦Ć ņĢŖņĢśņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. ņØ┤ļōż ņ”ØļĪĆ ļ¬©ļæÉ ļćīņŚ╝ņØ┤ ĒśĖņĀäļÉśĻ│Ā ļé£ ņØ┤Ēøä ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀ ņŚŁņŗ£ ĒśĖņĀäļÉśņŚłļŗż. ņØ┤ļŖö ļćīņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņŚÉņä£ ĻĄ¼ņĪ░ņĀüņØĖ ĒīīĻ┤┤Ļ░Ć ņŚåņŚłĻ│Ā, ņŚ╝ņ”ØņŚÉ ņØśĒĢ┤ ņØ╝ņŗ£ņĀüņ£╝ļĪ£ ĻĖ░ļŖźņןņĢĀĻ░Ć ņÖöļŗżĻ░Ć ļćīņŚ╝ņØ┤ ĒśĖņĀäļÉśļ®┤ņä£ ļćīņØś ĻĖ░ļŖźļōżņØ┤ ņĀĢņāüņĀüņ£╝ļĪ£ ĒÜīļ│ĄļÉśņŚłļŗżļŖö Ļ▓āņØä ņØśļ»ĖĒĢ£ļŗż.
ņäĖ ņ”ØļĪĆ ļ¬©ļæÉ ļćīņŚ╝ņ£╝ļĪ£ ņØĖĒĢ┤ ņĀäļ░śņĀüņØĖ ļćīĻĖ░ļŖźņןņĢĀĻ░Ć ļ░£ņāØĒĢśņśĆĻ│Ā, ņØ┤ļĪ£ ņØĖĒĢ┤ ņłśļ®┤ĻĄ¼ņĪ░ņØś ĒīīĻ┤┤ņÖĆ ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ļ░£ņāØĒĢśņśĆļŗż. Ēü┤ļĪ£ļéśņĀ£Ēī£ņŚÉ ņ╣śļŻīļ░śņØæņØ┤ ņóŗņĢśĻ│Ā, ņØ┤Ēøä ņĢĮņØä ļüŖĻ│ĀļÅä ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ņ£Āļ░£ļÉśņ¦Ć ņĢŖņĢä ļćīņŚ╝ņØ┤ ĒśĖņĀäļÉśļ®┤ņä£ ņØ┤ļĪ£ ņØĖĒĢ£ ļćīĻĖ░ļŖźņןņĢĀĻ░Ć ĒÜīļ│ĄļÉśņ¢┤ ņłśļ®┤ņןņĢĀļÅä ĒśĖņĀäļÉśņŚłļŹś Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. ļćīņŚ╝ Ēøä ļ░£ņāØĒĢśļŖö ņłśļ®┤ ņżæņØś ņØ┤ņāüĒ¢ēļÅÖņŚÉ ļīĆĒĢ┤ ļ©╝ņĀĆ ļ░£ņ×æņØś Ļ░ĆļŖźņä▒ņØä Ļ│ĀļĀżĒĢĀ Ļ▓āņØ┤ļŗż. ĒĢśņ¦Ćļ¦ī ņ”ØļĪĆņØś ĒÖśņ×Éļōżņ▓śļ¤╝ ļćīņŚ╝ Ēøä ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀĻ░Ć ļÅÖļ░śļÉśļŖö Ļ▓ĮņÜ░ļÅä ņ׳ņ£╝ļ»ĆļĪ£ ņØ┤ņŚÉ ļīĆĒĢ£ Ļ┤Ćņŗ¼ņØä Ļ░Ćņ¦äļŗżļ®┤ ņłśļ®┤ļŗżņøÉĻ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ ņØ┤ļź╝ ņ¦äļŗ©ĒĢĀ ņłś ņ׳ņ£╝ļ®░ ņ╣śļŻīĻ░Ć Ļ░ĆļŖźĒĢśļŗż. ņĢäņ¦ü ļćīņŚ╝ ĒøäņŚÉ ļ░£ņāØĒĢśļŖö ņłśļ®┤ĻĄ¼ņĪ░ņØś ĒīīĻ┤┤ ļ░Å ļĀśņłśļ®┤Ē¢ēļÅÖņןņĢĀņØś ļ¬ģĒÖĢĒĢ£ ĻĖ░ņĀäņØĆ ļ░ØĒśĆņ¦Ćņ¦Ć ņĢŖņĢśņ¦Ćļ¦ī ņ”ØļĪĆļ│┤Ļ│ĀļōżņØ┤ ļ¬©ņŚ¼ ņØ┤ņŚÉ ļīĆĒĢ£ ĻĖ░ņĀäņØ┤ ļ░ØĒśĆņ¦ĆĻĖ░ļź╝ ĻĖ░ļīĆĒĢ┤ļ│Ėļŗż.